В периодах электроотрицательность элементов возрастает с увеличением заряда ядер атомов (т. е. слева направо), а в главных подгруппах — снизу вверх.
Внимание! Новая тема. Вспоминаем, что такое электроны, как они могут перемещаться по орбиталям. Красным цветом – записываем. Рисунок – перерисовываем!
Девятнадцатое мая
Классная работа
Ковалентная химическая связь: неполярная и полярная.
Смотрим материал: https://www.youtube.com/watch?v=0cPjHksqNaQ
Атомы разных элементов по-разному относятся к общим электронным парам: те неметаллы, что сильнее, будут сильнее оттягивать к себе общие электронные пары, совсем как у Крылова: «У сильного всегда бессильный виноват».
Эта способность атомов химических элементов оттягивать к себе общие электронные пары называется электроотрицательностью (ЭО).
ЭО — это условная, безразмерная характеристика именно атома элемента. Численные значения ЭО атомов химических элементов приведены в Периодической системе элементов.
Зависимость ЭО элемента от положения его в ПСХЭ:
В периодах электроотрицательность элементов возрастает с увеличением заряда ядер атомов (т. е. слева направо), а в главных подгруппах — снизу вверх.
Чем больше ЭО элемента, тем сильнее его атомы притягивают электроны и труднее их отдают. Наибольшую электроотрицательностьность среди элементов имеют атомы фтора (4,1), а наименьшую — атомы цезия, франция (0,86).
У атомов металлов электроотрицательность обычно меньше 1,8—2,0, а у атомов неметаллов — больше 1,8—2.
Общие электронные пары смещаются в сторону более электроотрицательного элемента, и чем больше разность величин ЭО (ΔЭО) связанных атомов, тем больше полярность связи.
Ковалентная полярная и неполярная связь:
Например, полярность связи в молекуле фтороводорода НF больше, чем в молекуле хлороводорода НСl, так как фтор электроотрицательнее хлора.
В формулах соединений химический знак менее электроотрицательного элемента пишется, как правило, на первом месте.
Итак, ковалентная связь — это химическая связь между атомами, осуществляемая с помощью общих электронных пар.
Ковалентная неполярная связь — это связь между атомами с одинаковой электроотрицательностью; при образовании неполярной связи общие электронные пары в равной степени принадлежат обоим атомам (H2, Cl2, N2, O2…).
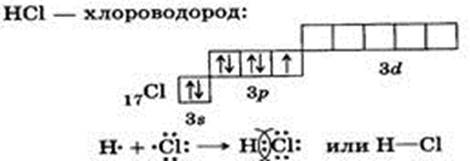
Ковалентная полярная связь — это связь между атомами, которые незначительно различаются по электроотрицательности; при образовании полярной связи общие электронные пары смещаются в сторону атома более электроотрицательного элемента (SCl2, H2S, HCl, CH4…).
Ковалентная связь возникает только между атомами неметаллов!
Ковалентная связь. это связь, возникающая между атомами в результате образования общих электронных пар. Определяется по числу свободных электронов по формуле 8 – номер группы.
Ковалентная неполярная:
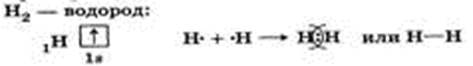
Ковалентная полярная связь.
Кратность ковалентной связи - число общих электронных пар, связывающих атомы. одинарные: водород; двойные: кислород; тройные: азот.
Домашнее задание: указать вид связи веществ: кислород, водород, азот, углекислый газ, фтороводород, аммиак. Объяснить выбор.








