Свойства и способы получения щелочей
ОСНОВАНИЯ
Основания — это сложные соединения, в состав молекул которых входит атом металла и гидроксогруппа ОН:
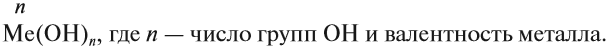
Валентность ОН-группы равна I.
Основания называют по схеме:
гидроксид (чего?) металла (n),
где n — переменная валентность металла.
Например:
- Са(ОН)2 — гидроксид кальция,
- Fе(OH)3 — гидроксид железа (III),
- NH4OH — гидроксид аммония.
Обратите внимание. В состав последнего основания не входит атом металла. Это исключение. Валентность группы NН4 (аммоний) равна I.
Основания бывают растворимые в воде и нерастворимые в воде. Это легко определить по таблице растворимости.
Растворимые в воде основания называются ЩЕЛОЧАМИ. В состав щелочей входят атомы активныхметаллов (они находятся в начале ряда напряжений, до магния). Гидроксид аммония тоже относится к щелочам, так как существует только в растворах.
СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ ЩЕЛОЧЕЙ
Щёлочи можно получить действием активного металла (К, Nа, Cа, Ва) или его оксида на воду:
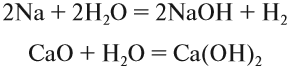
1. Растворы щелочей реагируют с кислотными и амфотерными оксидами и с кислотами. Последняя реакция называется реакцией НЕЙТРАЛИЗАЦИИ:
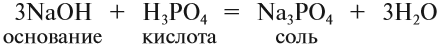
Реакция нейтрализации характерна для всех кислот!
2. Растворы щелочей реагируют с растворами солей. Реакция происходит, если образуется хотя бы одно нерастворимое соединение. Эта реакция относится к реакциям обмена, т. е. в результате получается новая соль и новое основание:
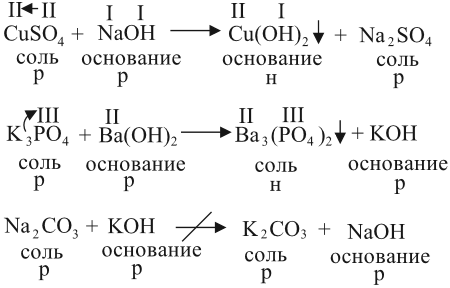
- Последняя реакция не происходит, так как оба полученных вещества растворимы в воде.
- Валентности составных частей исходных молекул определяйте по кислотному остатку или по числу групп ОН.
- Полученные значения валентностей используйте при составлении формул полученныхвеществ.
- Растворимость получаемых веществ определяйте по таблице растворимости.
3. Растворы щелочей, как и растворы кислот, способны изменять окраску индикаторов:
- фиолетовый лакмус синеет,
- оранжевый метилоранж желтеет,
- бесцветный фенолфталеин краснеет.
Все изменения окрасок индикаторов можно свести в таблицу 5.

Обратите внимание: если к воде добавить кислоты, то в растворе будет кислая среда; если добавить щелочь — щелочная; в чистой воде среда нейтральная.
Вопрос 1. Можно ли при помощи фенолфталеина узнать, что налито в стакане: вода? НCl? КОН? А при помощи лакмуса?
Вопрос 2. Почему реакция между кислотой и щелочью названа реакцией нейтрализации?
СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ НЕРАСТВОРИМЫХ В ВОДЕ ОСНОВАНИЙ
Среди нерастворимых в воде оснований следует выделить особую группу веществ — амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения их такие же, как и для нерастворимых оснований.
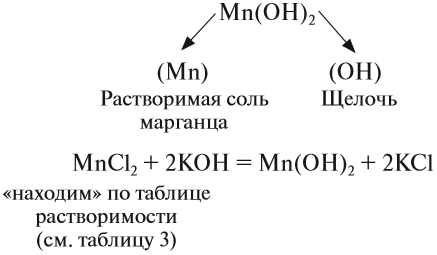
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щёлочи:
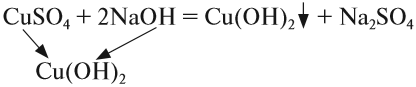
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца (II):
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей: нерастворимые в воде основания не могут реагировать с растворами солей, а также с амфотерными и некоторыми кислотными оксидами. Они не изменяют окраску индикатора.
1. Нерастворимые основания могут реагировать с кислотами, если при этом происходит растворениеисходного нерастворимого вещества (осадка):
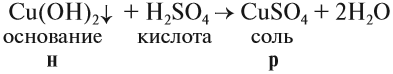
Таким образом, эта реакция возможна, если образуется растворимая соль (см. таблицу 3).
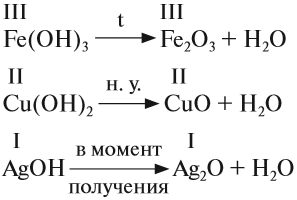
2. Нерастворимые основания разлагаются при нагревании. При этом, чем меньше активность металла (см. ряд напряжений), тем легче основание разлагается на оксид и воду:
СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
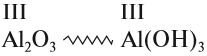
Как вы думаете, почему эти вещества называются амфотерными?
Ответ простой — амфотерные соединения проявляют двойственные свойства,
т. е. реагируют и с кислотами, и со щелочами (и растворяются при этом):
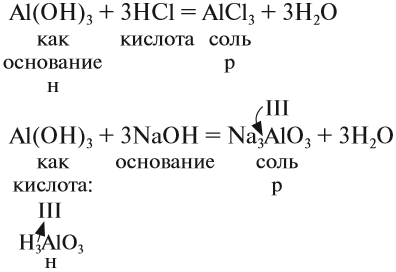
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2)* образуется сложное комплексное соединение:
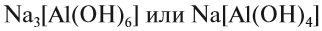
* Ортоалюминиевая кислота H3AlO3 теряет молекулу H2O, и образуется метаалюминиевая кислота HAlO2, в которой кислотный остаток AlO2 имеет валентность I.
ВЫВОДЫ
Молекулы неорганических оснований содержат гидроксогруппу ОН. Все неорганические основания, кроме NH4OH, содержат атом металла. Основания делят на растворимые в воде (щёлочи) инерастворимые в воде.
Растворы щёлочей реагируют:
- с кислотами (реакция нейтрализации),
- с кислотными и амфотерными оксидами,
- с растворами солей.
Щёлочи обнаруживаются индикаторами в щелочной («синей») области. Нерастворимые в воде основания не изменяют окраску индикатора, могут реагировать с некоторыми кислотами и кислотными оксидами, а также термически неустойчивы.








