Тема 1.1 « Основные законы идеальных газов »
20.02.02. ОП.03. Раздел 1. « Термодинамика »
Тема 1.1 « Основные законы идеальных газов »
Занятие №1. «Основные понятия и определения. Основные параметры газов»
Термодинамика представляет собой науку о взаимных превращениях различных видов энергии. Она не рассматривает вопросов, связанных с микрофизическим механизмом изучаемых явлений. Основу термодинамики составляют фундаментальные законы природы. Они называются законами или началами термодинамики. Благодаря высокой достоверности и независимости этих законов от свойств конкретных тел термодинамика успешно решает разнообразные задачи технического характера. На основе термодинамики разрабатывают новые и совершенствуют существующие тепловые машины и установки и создают высокоэффективные технологии, обеспечивающие экономнее расходование энергетических и материальных ресурсов. Совокупность инженерных приложений термодинамики образует се раздел, называемый технической термодинамикой.
Идеальные и реальные газы
Под идеальными понимают такие газы, в которых отсутствуют силы взаимодействия между молекулами, а сами молекулы принимаются за материальные точки, равномерно распределенные и не имеющие объема.
В природе идеальных газов нет. Однако часто встречаются такие реальные газы, н которых силы взаимодействия между молекулами и объемы самих молекул чрезвычайно малы. Такие газы принимают за идеальные.
Наиболее распространенными газами, применяемыми в технике, и которые в теплотехнических расчетах вполне допустимо считать идеальными, являются: кислород, водород, азот, окись углерода, углекислый газ, метан и практически все реальные газы, за исключением водяного пара, можно считать идеальными. Но если водяной пар перегрет и является частью газовых смесей, то его парциальное давление маю, а температура велика. В этом случае он далек от состояния жидкости. Такой пар можно считать идеальным.
В реальных газах в отличие от идеальных существенны силы меж молекулярных взаимодействий, и пренебрегать объемом молекул нельзя. В таких газах молекулы могут сближаться между собой только до некоторого минимального расстояния, гак как между молекулами возникают силы отталкивания. Поэтому можно считать, что свободный для движения удельный объем будет равен v — b , где b — тот наименьший удельный объем, до которого можно сжать газ, а v — удельный объем сосуда. В соответствии с этим длина свободного пробега молекул уменьшается, и давление увеличивается по сравнению с идеальным газом в отношении
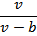
Основными параметрами газов считают: удельный объем о, абсолютное давление р и абсолютную температуру Т.
Переход рабочего тела из одного состояния в другое под влиянием внешних воздействий называют термодинамическим процессом.
Удельный объем v , м3/кг, представляет собой объем единицы массы вещества:
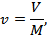
где V — объем, занимаемый веществом, м3; М — масса вещества, кг.
Плотностью ρ, кг/м3, называется величина, обратная удельному объему v:
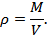
Тогда
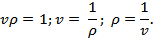
Температура характеризует степень нагретости тела. Это мера средней кинетической энергии тела. Чем больше средняя скорость движения молекул, тем больше температура газа.
Температуру измеряют в двух шкалах: в градусах шкалы Цельсия (°С) и в градусах шкалы Кельвина (К).
В качестве точки отсчета на шкале Цельсия берется так называемая тройная точка состояния воды, для которой характерно существование трех фаз вещества (вода, пар и лёд), находящихся в термодинамическом равновесии. Тройной точке воды соответствует температура 273 К или О °С.
На шкале Кельвина точкой отсчета является температура абсолютного нуля (О К), при которой прекращается тепловое движение молекул.
Между температурами, выраженными в градусах Кельвина и Цельсия, существует зависимость
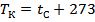
Давление р с точки зрения молекулярно-кинетической теории есть средний результат уларов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, н котором находится газ. Значение давления определяется по следующей формуле:
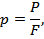
где Р — нормальная составляющая силы, Н; F — площадь поверхности, перпендикулярная к действующей силе, м2.
В системе СИ за единицу давления принят Паскаль (Па), 1 Па — 1 Н/м2. Существуют и внесистемные единицы давления: 1 бар = 1 атм = 105 Па = 760 мм рт. ст. = 10 200 мм вод. ст.
Давление бывает: абсолютное, манометрическое, атмосферное, или барометрическое, и вакуумметричсское. Эти давления связаны следующими выражениями:
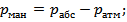
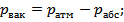
где рабс — абсолютное давление; рман — манометрическое давление; рбар = ратм — барометрическое или атмосферное давление; рвак — вакуумметрическое давление.
Вопросы и задания:
1. Что представляет собой «Термодинамика»?
2. Что разрабатывают на основе термодинамики?
3. Что такое «идеальный газ»?
4. Какие газы допустимо считать идеальными?
5. Чем реальные газы отличаются от идеальных*?
6. Что такое термодинамический процесс?
7. Что такое удельный объем? (Дать развернутый ответ с формулой**).
8. Что такое плотность? (Дать развернутый ответ с формулой*).
9. Что такое степень нагретости?
10. В каких шкалах измеряется температура?
11. Какова зависимость между температурами, выраженными в градусах Кельвина и Цельсия?
12. Что такое давление р с точки зрения молекулярно-кинетической теории? (Дать развернутый ответ с формулой**).
13. Какое бывает давление?
КРИТЕРИИ ОЦЕНКИ
выполнения и защиты заданий
по общепрофессиональным предметам и МДК
| Показатель | Балл |
| Задание, в рабочей тетраде, выполнено следующим образом: написан вопрос и после слова ОТВЕТ написан правильный и подробный ответ на вопрос (или выполнено задание) с использованием учебного материала изучаемой темы. Допекается вместо вопроса и слова ОТВНТ писать соответствующие вопросу заголовки, при этом правильная нумерация вопросов обязательна! Правильно выполнены все задания и приведены ответы на ВСЕ вопросы. Даны четкие правильные ответы на три вопроса по выбору преподавателя, выявляющие понимание и осознание учебного материала и характеризующие прочные знания, изложенные в логической последовательности с использованием принятой терминологии. При этом допускается обмолвки и оговорки по невнимательности, которые легко исправляются по требованию преподавателя! | «5» |
| Задание, в рабочей тетраде, выполнено следующим образом: указан номер вопроса (задания) и после слова ОТВЕТ написан правильный ответ на вопрос (или выполнено задание) с использованием учебного материала изучаемой темы. Поощряется вместо вопроса и слова ОТВНТ писать соответствующие вопросу заголовки, при этом правильная нумерация вопросов обязательна! Правильно выполнены все задания и приведены ответы на все вопросы без звездочек и дополнительно на вопросы и задания, отмеченные звездочкой (*). Даны правильные устные ответы на два вопроса по выбору преподавателя, отмеченные звездочкой (*) в определенной логической последовательности. При этом допускается обмолвки и оговорки, которые исправляются с помощью «наводящих» вопросов преподавателя! ИЛИ Правильно и подробно выполнены ВСЕ задания и приведены верные и подробные ответы на все вопросы. | «4» |
| Задание, в рабочей тетраде, выполнено следующим образом: указан номер вопроса (задания) и написан правильный ответ на вопрос (или выполнено задание) с использованием учебного материала изучаемой темы. Правильно выполнены только те задания и приведены правильные ответы только на те вопросы, которые НЕ отмечены звездочками. | «3» |
ВНИМАНИЕ!
1. Отвечать на вопросы (выполнять задания) можно не по порядку, но обязательно указывать правильный номер вопроса!
2. Допускается не писать ответы на 20% (от общего количества вопросов) вопросов, но только тех, которые не отмечены звездочками, НО с обязательным устным ответом на данные вопросы при защите работы!








