Виды химической связи, их характеристика
Ковалентная связь — это связь, между атомами неметаллов, возникающая за счёт образования общей пары электронов.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью . Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
Ковалентная неполярная связь – при взаимодействии одинаковых атомов неметаллов, электроотрицательности атомов равны - неМе1-неМе1
Кратность от связи (количество пар электронов) от одной до 4.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, две - в молекуле кислорода О2; три — в молекуле азота N2).
Чем больше кратность связи, тем она прочнее, и тем меньше длина связи.
Например, СН3-СН3, СН2=СН2, СН≡СН
Ковалентная полярная связь - взаимодействуют атомы разных неметаллов, для которых существует незначительная разность электроотрицательности неМе1-неМе2
Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами.
Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионная связь возникает между ионами
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Соединения: бинарные Ме-неМе, соли Ме-кислотный остаток, основания Ме-ОН
Характеристика: непрочная, сильнополярная.
Классификация ионов:
Катионы, анионы;
Простые, сложные
Одно-, двух-, трехзарядные.
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов. Металлическая связь описывается многими физическими свойствами металлов, такими как прочность, пластичность, теплопроводность, удельное электрическое сопротивление и проводимость, непрозрачность и блеск.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F.
Водородные связи могут быть межмолекулярными или внутримолекулярными.
Например, внутримолекулярные водородные связи в молекуле ДНК, вторичной структуре белковой молекулы,
Межмолекулярные водородные связи – Н2О, НF, NH3.
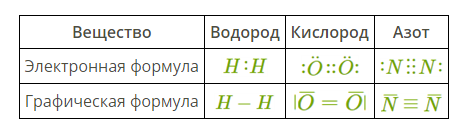
Электронные и графические формулы
Для изображения ковалентных связей используются электронные или графические (структурные) формулы.
В электронных формулах каждый электрон обозначают точкой, общую электронную пару — парой точек, расположенной между связанными атомами. Несвязывающие электронные пары указывают над, под и рядом с химическим символом элемента.
В графических формулах каждая электронная пара обозначается чёрточкой.
Закрепление знаний. Самостоятельная работа
Для данных веществ CO , Br2 , NH3 , Mg , O2 , BaCl2
Определите по формуле вещества тип химической связи.
Составьте структурные и электронные формулы соединений.
4. Домашнее задание. Читать параграфы 7, 8, выполнить письменно № 3 стр. 34. Для соединений с ковалентной связью из №3 стр.34 составьте, кроме электронных, еще и структурные формулы.
Ребята, выполняйте все задания, СОБЛЮДАЙТЕ ТРЕБОВАНИЯ ОРФОГРАФИЧЕСКОГО РЕЖИМА (дата прописью, форма работы – классная или домашняя работа, тема урока, и т.д.). Дата классной и контрольной работы должна соответствовать дате урока по расписанию (эта дата указана в файле по предмету и в его названии).
Выполненные задания присылайте в виде документа Microsoft Office Word. В файл Word скопируйте выполненные задания (фото выполнения работы в рабочей тетради), подпишите файл - Фамилия, имя, класс, предмет, дата урока (например, Петров И., 11-Б класс, Химия, 06.09.2022), и вышлите учителю, Мартыновой Любовь Петровне в ВК https://vk.com/id344300643.








