Подгруппа кислорода.
Замечание. Халькогенами (рождающими земли) называют элементы подгруппы кислорода – кислород, серу, селен и теллур. Полоний к ним не относится.
§ 7. Кислород и озон.
Истинный химик должен пить все что горит.
А то, что не горит – поджечь и немедленно выпить.
Химическая байка.
В химической лаборатории есть и пить запрещено.
Суровая правда жизни
и инструкция по технике безопасности.
7.1 Физические свойства. Кислород (электронная конфигурация [He]2s22p4) – бесцветный газ без запаха, малорастворимый в воде. Однако даже те жалкие 31 мл на литр воды, в при атмосферном слое океана, достаточны для глубинных организмов. Рыба не фотосинтезирует, да в и целом солнечный свет глубже ста метров, практически в воду не проникает. А вокруг черных курильщиков на дне своя жизнь. Поживи-ка в кипящей кислоте… Сжижается с трудом, образуя голубую парамагнитную жидкость. Твердый кислород синий.
7.2 Электродные потенциалы представлены на диаграмме.
Кислая среда
0 –I –II
O2 0,695 H2O2 1,763 H2O
Щелочная среда
0 –I –II
O2 –0,0649 HO2- 0,867 OH-
Серьезный окислитель? Более чем. Мы вообще все должны сгореть в кислороде по-хорошему. Но, во-первых, давление кислорода в атмосфере, всего лишь ~0,21 атмосферы, во-вторых, кислород, с точки зрения кинетики, «ленивый товарищ». Энергия связи в молекуле 498 кДж/моль, просто так на атомы «не разобрать». Ну а в-третьих, истинный мастер с одной спички без бензина под дождем костер разводит. А древний мастер – еще и без спички.
7.3 Химические свойства. Элементарный кислород не реагирует с инертными газами и галогенами, кроме фтора при охлаждении. Бытует мнение, что не реагируют с ним некоторые платиновые металлы, но это миф, зато золото инертно. Быстро в его атмосфере окисляются щелочные металлы – литий дает оксид, натрий пероксид, калий и его более тяжелые аналоги – надпероксиды, но обычно элементы образуют оксиды, нередко – высшие. Все реакции мы тут рассматривать не будем. Поговорим только чуть подробнее о реакциях с водородом. Механизм горения мы разберем в §8, здесь нас интересуют продукты. Если поджечь водород, собранный в пробирке проверяя его чистоту или просто так для интереса, он сгорает с образованием воды.
2H2 + O2 → 2H2O
Но направим струю горячего (до 2000 0С) пламени на поверхность, охлажденную чуть ниже 0 0С, например, на лед и обнаружим, что в продуктах реакции есть перекись (пероксид) водорода H2O2. Ее происхождение очевидно – рекомбинация гидрокисльных радикалов ·OH, а также атома водорода и гидропероксидного радикала HO2·. И ты немедленно спросишь, а могут гидропероксидный соединиться с гидроксилом, или сдвоится? Последнее, в условиях криохимии, в реакции с жидким кислородом дает H2O4 (H-O-O-O-O-H) – тетраоксид диводорода. H2O3 получают УФ-облучением охлажденной жидким воздухом смеси озона и водорода (при обычных условиях – не смешивать!). Оба продукта резко неустойчивы.
Реакции сложных веществ с кислородом, опять же преимущественно при нагревании, приводит к оксидам элементов. Устойчивы, как правило, галогениды, некоторые производные азота и углерода, но всё это опять же «на местах» будем разбирать.
7.4 Получение. Кислород в промышленности получают фракционным разделением воздуха. Помимо него, выделяются из воздуха азот и такие инертные газы, как неон, аргон, криптон и ксенон. В лаборатории легче всего получать из газового баллона, но если у вас баллона под рукой нет, а марганцовка есть, тогда
2KMnO4 (t) → K2MnO4 + MnO2 + O2
Нагрел, заполнил нужную тебе тару кислородом, дальше используй по назначению.
7.5 Озон. Получение, структура, свойства. При УФ-облучении, как это происходит в верхних слоях атмосферы, или в электроразряде как при грозах или в специальных озонаторе, кислород превращается в озон
3O2 (ħν) → 2O3
Озон бесцветный газ с характерным запахом свежести, в больших концентрациях сильно ядовит, и может даже вызывать отек легких. Обладает бактерицидными свойствами и быстро разлагает органические примеси в воде до воды, углекислого газа и азота. Сера превращается при этом серную кислоту. Но ее количество ничтожно мало, а железо, которые она вымывает в воду из труб, и так богато в воде представлено.
Сгущается в темно-синюю жидкость (161 К), твердый озон (81 К) почти черный. Молекула озона – полярная 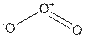 . В терминах валентных связей ее можно описать так – по два не спаренных электрона атомов кислорода образуют двойную связь, а третий связан с центральным за счет донорно-акцепторного взаимодействия. Где он берет свободную орбиталь? Для этого сдваиваются не спаренные электроны на двух p-орбиталях и получается одна вакантная и одна заполненная. Заполненная «живет своей жизнью», а вакантная взаимодействует с не поделенной электронной парой центрального атома. Естественно, что лучше применять для описания таких структур теорию МО ЛКАО.
. В терминах валентных связей ее можно описать так – по два не спаренных электрона атомов кислорода образуют двойную связь, а третий связан с центральным за счет донорно-акцепторного взаимодействия. Где он берет свободную орбиталь? Для этого сдваиваются не спаренные электроны на двух p-орбиталях и получается одна вакантная и одна заполненная. Заполненная «живет своей жизнью», а вакантная взаимодействует с не поделенной электронной парой центрального атома. Естественно, что лучше применять для описания таких структур теорию МО ЛКАО.
Химическая активность озона много выше, чем кислорода. Это сильнейший окислитель.
O3 + 2e + 2H+ → O2 + H2O (2,075 В)
O3 + 2e + H2O → O2 + 2OH- (1,246 В)
Он вступает в реакции, как правило, по двум основным схемам. Это присоединение электрона
O3 + e → O3-
4KOH + 4O3 → 4KO3 + 2H2O + O2
И перенос атома кислорода
Pt + 2O3 → PtO2 + 2O2
Реакцию озонолиза алкенов мы рассмотрим в 10-м классе.
7.6 Биологическая роль. Кислород важен для всех аэробных форм жизни, для анаэробных, типа гнилостных бактерий, ядовит. Входит в состав почти всех сколько-нибудь значимых биологических молекул, кроме некоторых продуктов разложения, включая белки, жиры, углеводы и витамины. Но про биохимию не в этой главе.
Озон в виде тонкого слоя (озоновый слой) в верхних слоях атмосферы образуется под действием ультрафиолетовых лучей наиболее жесткой части спектра (он также непрозрачен для них), защищая жизнь на Земле от излишков лучей этого диапазона (мягкий ультрафиолет позволяет нам загорать и работает на пользу организма в целом, но про витамин D в 11-м классе).
§8. Цепные реакции.
8.1 Введение. Мы уже разбирали в общих главах такие понятия как скорость и порядок реакции, ее молекулярность. Рассмотрим подробнее механизм цепных реакций.
8.2 Неразветвленные цепные реакции. Это реакции фтора, хлора, брома с водородом и углеводородами. Реакции с углеводородами, какой атом галогена в какой атом углерода (в случае хлора и брома, фтору все равно, там не взорваться бы) «вгрызается», мы рассмотрим в 10-м классе – кто, куда и с какой скоростью.
На первой стадии, называемой инициацией цепи, происходит образование свободных радикалов – частиц (атомов, в сложных случаях – молекул), под действием высокой температуры или излучения
Cl2 (hν) → 2Cl·
Радикал – это простая или сложная частица, содержащая неспаренный электрон. Многие изолированные атомы – радикалы, но поскольку они, как правило, входят в состав сложного вещества (например, H2, O2 и т. п.), то это совершенно неочевидно.
Развитие цепи – образование новых радикалов
Cl· + H2 → HCl + H·
H· + Cl2 → HCl + Cl·
Гибель цепи
H· + Cl· → HCl
Цепь также может обрываться, за счет рекомбинации атомов в исходные молекулы, за счет адсорбции активных частиц на стенках сосудов, а также за счет ингибиторов. Так молекула NO содержит неспаренный электрон у атома азота и перехватывает на себя активные радикалы хлора
NO + Cl → NOCl
NOCl + Cl → NO + Cl2
Если длина цепи очень велика, то мы можем создать химический лазер. Такой лазер на реакционной смеси дейтерий – фтор построен, но рассмотрим мы его в соответствующем параграфе.
8.3 Разветвленные цепные реакции. Это кислород-водородная реакция, а также сложно-схемные реакции горения углеводородов. Они характеризуются более сложными реакционными схемами. Первая стадия здесь расщепление молекулы водорода
H2 → 2H·
Образование гидропероксидного радикала
H· + O2 → HO2·
Образование пероксида водорода, который мы «ловим» закалкой смеси горящего водорода в кислороде
HO2· + H2 → H2O2 + H·
Разложение пероксида водорода
H2O2 → 2HO·
HO· +H2 → H2O + H·
Разветвление цепи возникает на стадии гидропероксидного радикала
HO2· → HO· +O:
O: + H2 → HO· + H·
§9 Сера.
9.1 Физические свойства. Желтый порошок (мелкораздробленная – серный цвет), в основном состоянии находится в виде циклических коронообразных молекул S8.

Рис. 9.1 Основное состояние серы.
При нагревании до 107 – 119 0С все формы упаковок этих молекул плавятся, превращаясь в вязкую массу, которая при нагревании темнеет. Это обусловлено образованием длинных цепей Sn, которые при дальнейшем нагреве постепенно разрываются, укорачиваются и при 427 0С сера переходит в желтый, парамагнитный газ, из молекул S2. Если расплавленную серу вылить в холодную воду, она превращается в резиноподобную массу – т.н. пластическую серу. При хранении, пластическая сера переходит в S8.
Сера – изолятор.
9.2 Химические свойства. Ознакомимся, хлопая глазками, с немалого размера
9.2.1 диаграммой потенциалов, в кислой
VI V IV III «II» 0 –II
SO42- -0,07 S2O62- 0,57 H2SO3 -0,07 HS2O4- 0,87 S2O32- 0,6 S 0,14 H2S
и щелочной средах
SO42- -0,94 SO32- -0,58 S2O32- 0,74 S -0,45 S2-
а также парой пероксодисульфат S2O82- / сульфат-ион SO42-, чей потенциал равен 2,01 В. В остальном же, нет ничего выдающегося.
9.2.2 Сера – вещество, при обычных условиях, мало реакционноспособное. Во фторе взрывается, образуя химически крайне инертный элегаз SF6. Свое название гексафторид получил от способа применения. Это газообразное вещество с большим потенциалом пробоя, что позволяет резко увеличить рабочие параметры трансформаторов на электростанциях, относительно масляных (т.е. с изоляционной средой на высших углеводородах, типа С30H62). Он не горюч, устойчив к воде, не действует на конструкционные материалы и не токсичен. В качестве примеси во время получения, при недостатке фтора образуется декафторид дисеры S2F10, превращаемый действием хлора в хлорпентафторид SClF5. Его используют химики органики, для введения группы SF5 в различные вещества. По обменным реакциям из хлоридов могут быть получены SF4, SF2 и S2F2. Практического значения не имеют
Под действием хлора или брома образуются S2Hal2 и SHal2. Для хлора характерно образование высшего, для брома низшего по степени окисления соединения. Дигалогениды дисеры, растворяют элементарную серу. SnCl2 (n = 2 – 8), используется для вулканизации каучука. С этим процессом мы познакомимся в 10-м классе. Также был получен нестойкий SCl4. Йод с серой не реагирует, образуя легкоплавкую смесь – эвтектику. Иодиды серы получают из хлоридов действием NaI в CCl4.
В кислороде сгорает, с характерным запахом сернистого газа
S + O2 → SO2
Вам этот запах хорошо знаком, достаточно зажечь обыкновенную спичку, в головку которой входит сера. С селеном и теллуром не реагирует. Сульсен (сельсун) – мелкодисперсная смесь элементов, применяемая при лечении себореи
2H2S + H2SeO3 → «SeS2»↓ + 3H2O
Из водных растворов производных полония был получен PoS. К азоту полностью инертна, но растворяется в жидком аммиаке
16NH3 + 10S → S4N4 + 6(NH4)2S
Со всеми остальными элементами образует многочисленные сульфиды, получаемыми как из элементов, так и косвенно. С родием и золотом не реагирует. Многие сульфиды – минералы. Тиокислоты типа HmЭSn, важнейшие сульфиды и персульфиды (содержащие ион S22-) мы рассмотрим в приложении соответствующих элементов.
В кислотах-окислителях превращается обычно в серную кислоту
S + 6HNO3(конц) → H2SO4 + 6NO2 + 2H2O
S + 2H2SO4 → 3SO2 + 2H2O
В щелочах диспропорционирует
S + 6NaOH (t) → 2Na2S + Na2SO3 + 3H2O
9.3 Получение серы. В промышленности сера получается как побочный продукт гидроочистки нефти. В нефти обычно содержится в виде сульфидов R1SR2, где R – углерод- и водородсодержащие группы, включая сложные кольца, где эти радикалы могут объединяться между собой. Поскольку нефть источник топлива, а сернистый газ SO2 ни разу не полезен, ни для материала моторов, ни для экологии, нефть и ее компоненты подвергают т.н. гидроочистке
R1SR2 + 2H2 →R1H + R2H + H2S
Сероводород сжигают умно – в недостатке кислорода. На самом деле имеет место комбинация двух реакций
2H2S + 3O2 → 2H2O + 2SO2
2H2S + SO2 → 3S + 2H2O
9.4 Биологическая роль. Структурная компонента белков и, следовательно, нужна всему живому на планете.
9.5 Применение серы. Сама сера применяется мало, а вот ее производные, в особенности серная кислота – ключевой продукт химической технологии, крайне важны. Если у вас государство несколько больше Андорры или пляжных островов, то у вас обязано существовать сернокислотное производство. А она вам и удобрения получать позволяет, и металлы из руд выщелачивать и электролиз водных растворов солей этих металлов – сульфатов вести, дабы металлы эти получить в чистом виде.
§ 10. Оксиды и кислоты серы.
10.1 Сероводород. Ядовитый газ, с характерным запахом тухлых яиц. В водном растворе слабая кислота. Сульфиды, кроме сульфидов щелочных металлов и аммония, в воде нерастворимы, хорошо растворимые гидросульфиды резко неустойчивы и могут быть получены в сухом виде только для вышеназванных катионов. Полученные сухими методами сульфиды Al и Cr (III), водой количественно гиролизуются.
10.2 Сернистый газ и сернистая кислота. Ядовитый газ с характерным запахом, одна из компонент окисления вулканических газов. Выделяющийся из-под земли сероводород, во время извержения сгорает, кроме того, если в состав магмы входят сульфиды, например природный персульфид – пирит, то при нагреве они также сгорают
4FeS2 + 11O2 (t) → 2Fe2O3 + 8SO2
Пирит довольно распространенный минерал. Его сжигают, выделившийся сернистый газ уходит в сернокислотное производство, а оксид железа – в доменную печь, для выплавки чугуна и стали.
В воде растворим, с образованием нестойкой и слабой сернистой кислоты
SO2 + xH2O ↔ SO2·xH2O ↔ H2SO3 + (x-1)H2O
При охлаждении из водного раствора может быть выделен клатрат (газогидрат) SO2·7H2O. Растворимость и устойчивость солей сернистой кислоты – сульфитов, аналогична сульфидам.
10.3 Модификации сульфитов. При пропускании сернистого газа через водную взвесь диоксида марганца получают дитионат (гекасоксодисульфат (V)) марганца
MnO2 + 2SO2 → MnS2O6
а через взвесь пыли цинка – дитионит (тетраоксодисульфат (III)) цинка
Zn + 2SO2 → ZnS2O4
Кипячение мелкораздробленной серы с растворами сульфитов дает тиосульфаты (триоксосульфидосульфаты (VI))
Na2SO3 + S (t) → Na2S2O3
Тиосульфат-ион хороший комплексообразователь, применяемый в химической фотографии (см. соответствующий §)
AgI↓ + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaI
Будучи сильным восстановителем, применяется в определении йода и других окислителей, с помощью которых он может быть получен. Например, окисленная форма Ox, с помощью I- переводится в восстановленную Red
Ox + 2I- → Red + I2
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Получаемый тетратионат натрия состоит из двух SO3- ионов, связанных дисульфидным мостиком -S-S-. Помимо ди- и тетратионатов известны и другие ионы Sx(SO3)22-.
С пентахлоридом фосфора образует полезный для химика-органика хлористый тионил (тионилхлорид)
PCl5 + SO2 → POCl3 + SOCl2
Присоединяет фтор и хлор обрзауя соответственно фтористый или хлористый сульфурил (сульфурилхлорид в реакции ниже)
SO2 + Cl2 → SO2Cl2
Тионилы и сульфурилхлорид водой разлагаются количественно, сульфонилфторид гидролизуется медленно.
10.4 Триоксид серы. В крайне незначительном количестве получается при свободном горении серы, но выход настолько микроскопический, что им можно во всех учебных задачах, где сгорают серусодержащие веществе пренебречь. В промышленности получается каталитическим окислением диоксида
2SO2 + O2 (V2O5) → 2SO3
С учетом катализатора V2O5
V2O5 + SO2 (t) → VO2 + VOSO4
VO2 + VOSO4 + O2 (t) → V2O5 + SO3
При н.у. это кристаллы, похожие лед (SO3)3 или асбест (SO3)n, настолько интенсивно реагирующие с водой, что образуется туман из капель серной кислоты. Сернокислотный туман – очень неприятная ситуация, и в промышленности триоксид серы поглощают не водой, а концентрированной серной кислотой, с образованием олеума H2SO4·xSO3. Его разбавление водой позволяет получать кислоту необходимой концентрации. Именно отсюда идет правило «сначала вода, потом кислота, иначе случится большая беда». Теплота гидратации серной кислоты очень велика и вызывает вскипание раствора. Оно вам надо, плюющую во все стороны банку с кислотой? Поэтому кислоту вливают в воду, а не в коем случае не наоборот!
Безводные галогенводороды реагируют с триоксидом серы по-разному. Фтороводород дает очень сильную, устойчивую к воде фторсульфоновую кислоту HSO3F. Разложением ее солей – фторсульфонатов (фтортриоксосульфатов (VI)), можно получать сульфурилфторид
Ba(SO3F)2 (t) → BaSO4 + SO2F2
Хлорсульфоновая кислота HSO3Cl боится влаги, в органической химии применяется для получения сульфокислот RSO3H. Бромсульфоновая кислота разлагается при низких температурах с выделением брома.
10.5 Серная кислота и сульфаты. При нагревании до 300 0С чистая серная кислота незначительно разлагается, а далее перегоняется в виде азеотропа с массовой долей кислоты в 96%. Пары серной кислоты входят в состав облачного слоя планеты Венера. В водном растворе относится к типичным сильным кислотам и практически не образует комплексных анионов (плохой комплексообразователь). Соли серной кислоты – сульфаты, как правило, растворимы и образуют гидраты. Пентагидрат сульфата меди CuSO4·5H2O и гептагидрат сульфата железа (II) FeSO4·7H2O – купоросы медный и железный соответственно. Сама концентрированная серная кислота называется, кстати, купоросным маслом. Гидратированные двойные сульфаты катионов +1 и +3, часто называют квасцами, например алюмокалиевые квасцы KAl(SO4)2·12H2O. Соль Мора – гексагидрат сульфата железа (II) – аммония (NH4)2Fe(SO4)2·6H2O, типичный реагент в аналитической химии. Нерастворимы сульфаты свинца (II), стронция, бария и радия. Малорастворим Ag2SO4 и сульфаты кальция, разной степени гидратированности. Гемигидрат сульфата кальция CaSO4·0,5H2O (гипс), смешанный с водой, образует пластичную массу, которая позволяет накладывать фиксирующие повязки при переломах, лепить небольшие скульптуры – например, гипсовые статуи. Излишняя вода присоединяется к гемигидрату и получается твердый (как говорят, гипс схватывается), практически нерастворимый дигидрат.
Концентрированная серная кислота сильный окислитель, реагирует со многими металлами и неметаллами, образуя сульфаты или кислоты/оксиды и SO2. В литературе встречаются сообщения, что восстановление может идти до серы или даже сероводорода, но следует помнить, что эти вещества также окисляются концентрированной кислотой. Поэтому на экзаменах и олимпиадах смело пишите SO2 как продукт восстановления. Алюминий, хром и железо в концентрированной серной кислоте пассивируются. Это удобно и серную кислоту можно перевозить в стальных цистернах.
10.6 Превращения сульфатов. Гидросульфаты металлов растворимы в воде и серной кислоте, поэтому если даже свинец и спрятался под пленкой нерастворимого сульфата, то
PbSO4↓+ H2SO4(конц) → Pb(HSO4)2
Давайте возьмем гидросульфат калия и нагреем его
2KHSO4 (t) → K2S2O7 + H2O↑
Получается пиросульфат (гептаоксодисульфат) калия. Сама кислота (дисерная или пиросерная) входит в состав олеума, а водой пиросульфаты постепенно разлагаются.
Гидросульфаты также можно использовать для перевода в раствор альфа-форм оксида алюминия и хрома, растворение которых – задача нетривиальная
6KHSO4 + α-Al2O3 (t) → 3K2SO4 + Al2(SO4)3 + 3H2O↑
Подвергнем теперь гидросульфат-ион электролизу
2HSO4- (±) → H2↑ + S2O82-
Получают соли пероксодисерной кислоты (гексаоксопероксодисульфаты). Они медленно гидролизуются с образованием солей серной и пероксомоносерной (триоксогидропероксосульфатов) кислот
K2S2O8 + H2O → KHSO4 + KHSO5
Пероксомоносерная кислота H2SO5 носит название кислоты Каро и является слабой при диссоциации по второй ступени – водород от пероксогруппы OOH отщепляется с трудом и ее соли обычно представляют собой гидропероксотриоксосульфаты. Пероксосульфаты (персульфаты) – сильные окислители
2Ag+ + S2O82- → 2Ag2+ + 2SO42-
10.7 Определение серы. Все формы серы, кроме гексафторида, которые следует количественно определить в образце, окисляют, тем или иным способом до сульфат-иона и осаждают в виде сульфата бария. Бумажный фильтр с осадком помещают во взвешенный сухой тигель и озоляют фильтр при 900 0С. По разнице между сухим тиглем и тиглем с осадком, определяют количество сульфата.








