§ 6. Сравнение соединений галогенов и дополнительные сведения.
6.1 Фториды кислорода. Кислород непосредственно взаимодействует с фтором с образованием резко неустойчивых дифторидов поликислорода OnF2, где n изменяется от 2 до 6, устойчивость которых быстро падает с ростом n, а цвет углубляется от оранжевого до красно-бурого. Даже дифторид дикислорода (в литературе встречается термин монофторид кислорода) O2F2 быстро разлагается выше 200 К. Дифторид кислорода OF2, может быть получен пропусканием фтора через разбавленный раствор щелочи (в концентрированном происходит разложение фторида, с образованием кислорода). Фторид кислорода (II) – мощный фторирующий агент. Например,
ClF + OF2 → 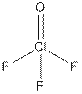
ClOF3, подобно другим оксифторидам хлора (ClO2F, ClO2F3, ClOF5 и ClO3F) – мощный окислитель и фторирующий агент.
6.2 Кислородные кислоты галогенов и их соли. Каждый из тройки галогенов – хлор, бром и йод, образует по четыре кислоты со степенями окисления +1, +3, +5 и +7. Степень окисления +1 реализуется в кислотах HЭO. Их устойчивость, кислотность и стабильность их самих и их солей быстро падает от хлора к йоду. Для йода не исключаются реакции по основному типу
HIO + H+ = H2O + I+
Кислоты типа HЭO2 наименее устойчивы. HЭO3 соединения более стабильны, HIO3 даже может быть выделена в свободном виде.
Кислоты брома и хлора при концентрировании взрывообразно разлагаются с выделением галогенводорода и кислорода. Соли более стабильны, но в отличие от KСlO3 производные брома и йода при нагревании не диспропорционируют, а разлагаются с выделением кислорода.
2KBrO3 = 2KBr + 3O2
Высшие кислоты отвечают формуле HClO4, HBrO4 и H5IO6. Первая и вторая сильные, третья слабая кислота.
6.3 Оксиды галогенов. Единственным экзотермическим оксидом галогенов является оксид йода (V). Вторым по стабильности может быть назван также оксид йода состава I4O9, который правильнее называть триоксойодатом (V) йода (III) I3+(IO3)3. Он отвечает основной функции не полученного в свободном состоянии I2O3. Менее стабильны оксиды хлора – жидкие Cl2O7, Cl2O6 и газообразные ClO2 и Cl2O. Они достаточно устойчивы при обычных условиях, но склонны взрываться при стоянии или нагреве. В то же время все известные оксиды брома очень быстро разлагаются – и Br2O и BrO2 не выдерживают нагревания выше 270 К. Оксиды брома обычно получают методами криохимии из элементов. Сообщалось также о синтезе I2O4, I2O7, Br2O3, Br2O5, Br3O8 и BrO3. Для хлора методами криохимии синтезированы ClClO, ClOO, Cl2O3 и ClO.
Таким образом, обобщая вышесказанное этого и предыдущих параграфов, можно указать следующие тенденции. По ряду Cl – Br – I идет быстрая дестабилизация соединений HЭO и HЭO2, кислоты типа HЭO3 наоборот стабилизируются, то же касается и солей этих кислот. Для состояния (VII) имеет место ярко выраженная вторичная периодичность. Кроме того, для йода увеличивается координационное число в высших стабильных соединениях. Это также характерно для теллура, в меньшей степени сурьмы. Для p-элементов 6 периода, этот эффект не выявлен. Не стабильность высших соединений в целом, уход от солей кислот к двойным оксидам, а, начиная с полония, еще и радиоактивность, накладывающая на исследователя и даже лабораторию, дополнительные требования, не способствуют уточнению наших знаний.
6.4 Межгалоидные соединения. Межгалоидными соединениями называют соединения галогенов друг с другом, причем все они получаются прямым взаимодействием элементов. Тенденции по их устойчивости в целом соответствуют кислородным соединениям. Стабильность моно- и трифторидов быстро падает, в то время как устойчивость пентафторидов растет. Указать на наличие вторичной периодичности для гептафторидов тяжело. Это связано с их существенной нестабильностью – производное хлора существует только в комплексном виде, в форме катиона гексафторхлорония (VII) ClF6+. Аналогичное производное известно для брома. Йод (бром – сомнительно) образует простой гептафторид IF7, единственное межгалоидное соединение, получаемое в две стадии, включающие свободное горение йода (спектральными методами в пламени обнаружен IF)
I2 + 5F2 = 2IF5
и последующее окисление охлажденного пентафторида.
IF5 + F2 = IF7
Других межгалоидных соединений известно немного. Это BrCl (сильно диссоциированный на элементы в обычных условиях), ICl (который существует в ионной I+Cl- и молекулярной ICl форме, что указывает на некоторую амфотерность йода), ICl3 и IBr. В целом, распределение составов межгалоидных соединений соответствует положению элементов в периодической системе.
Пентафториды брома и йода, трифторид брома, хлориды и бромиды йода, присоединяются к соответствующим галогенидам щелочных и некоторых других металлов, с образованием комплексных солей
KCl + ICl → K[ICl2]
Все межгалоидные соединения химически очень активны. Как правило, реакции с их взаимодействием, приводят к высшим галогенидам, при этом менее электроотрицательный галоген выделяется в виде элемента. Это можно продемонстрировать следующими реакциями
2BrF3 + 2Au = Br2 + 2AuF3
2ClF3 + W = Cl2 + WF6
KI + IBr = KBr + I2
Как мы видим, активность фторидов галогенов достаточно высока. Более того, фториды хлора являются столь мощными окислителями, что в вентилях газовых баллонов, в которых они содержатся, недопустимы никакие прокладки, кроме тефлоновых. Порошкообразное (цельнолитое медленнее) золото растворяется в теплом жидком BrF3 и горит в ClF3. Во время Второй Мировой войны фашисты предполагали использовать ClF3 в качестве зажигательного средства, однако завод по его производству был захвачен в 1944 году, прежде, чем успел заработать на полную мощность.
6.5 Ионная диссоциация. В предыдущих главах мы рассматривали электролитическую диссоциацию в водных растворах. В принципе, идея электролитической диссоциации и кислотно-основных равновесий применима для всех аутодиссоциирующих растворителей. Наиболее подробно ситуация изучена для BrF3, хотя пентафториды брома и йода также обладают соответствующими свойствами. Итак, в жидком трифториде брома происходит следующая реакция
2BrF3 = BrF2+ + BrF4-
Соответственно все фториды будут по отношению к фториду брома либо кислотами, либо основаниями. Мы не случайно в п. 5.4 привели реакцию фторирования золота, а ниже указали, что оно растворяется. В избытке окислителя имеет место реакция
4BrF3 + 2Au = 2[BrF2+][AuF4-] + Br2
Раз есть кислоты, есть и основания. К основаниям относятся фториды щелочных и щелочноземельных металлов, фторид серебра, кислоты – фторид золота, пентафторид сурьмы, тетрафторид титана и другие соединения. Имеют место и реакции нейтрализации
AgBrF4 + AuBrF6 = AgAuF4 + 2BrF3
Тетрафтораурат (III) серебра выделятся в виде желтого вещества из раствора в BrF3, при отгонке последнего в вакууме.
6.6 Биологическая роль. Фтор входит в состав зубов и костей. Хлорид-ион имеется в составе крови, соляная кислота содержится в желудке. Йод входит в состав гормонов щитовидной железы тиронина и тироксина. Бромид-ион в составе солей щелочных металлов – натрия или калия, используется как успокоительное.
6.7 Получение галогенов. Фтор получают электролизом расплава смеси гидрофторидов – от гидродифторида KHF2 до дигидротрифторида KH2F3.
Хлор получают в промышленности как побочный продукт производства натрия и гидроксидов натрия и калия
2NaCl(распл) (±) → 2Na + Cl2
2KCl + 2H2O (±) → 2KOH + H2 + Cl2
Бром и йод обычно выделяют из природных солевых концентратов, например
2NaI + MnO2 + 2H2SO4 → Na2SO4 + MnSO4 + I2 + 2H2O
Йод также может быть получен при переработке морских водорослей, особенно ламинарии, которой довольно много в наших северных и дальневосточных морях.
Астат получают облучением висмута альфа-частицами, в урановых рудах природные изотопы живут не более 2 с.
6.8 Применение. Применение галогенов и их производных настолько велико, что затруднительно даже подсчитать, сколько химико-технологических процессов, используется для получения тех или иных веществ с помощью галогенов или через их галогениды. Поэтому применять и мы будет по факту – т.е. при изучении химии конкретных элементов. Тоже касается и галогенводородов. Соляная кислота есть даже у вас в школе!
6.9 Заключение. В ряду галогенов сверху вниз по таблице Мендеелева, уменьшается химическая активность на окисление элементов-партнеров, дестабилизируется степень окисления +3 и +1. Так, если ClF можно получить в реакции между ClF3 (получается горением во фторе) и хлором, чтобы не подбирать условия синтеза, то BrF непрерывно разлагается на трифторид и бром. IF – вообще промежуточная частица, а IF3 не получен. Про него следует помнить, что не все авторы химических олимпиад знакомы с этим фактом. Степень окисления +5 становится превалирующей, а +7 подвержена влиянию вторичной периодичности.
Глава 2.








