Водород и галогены.
Часть 2.
Неорганическая химия.
Элементы главных подгрупп.
Глава 1.
Водород и галогены.
§ 1. Водород.
Выберем какой-нибудь металл М…
Из контрольных по химической кинетике НГУ
1.1 Физические свойства. Водород (перевод hydrogen – рождающий воду) – легчайший из известных газов, без вкуса и запаха, очень низкокипящий и низкоплавкий, химическая формула H2. В природе состоит из трех изотопов протия (обозначается H, реже 1H, Z=1, N=0), дейтерия (обозначается 2H, D, Z=1, N=1, соотношение с протием 1:6000) и трития (обозначается 3H, T, Z=1, N=2, содержащегося только в источниках интенсивной радиации). Тритий неустойчив и с периодом полураспада 12,6 года превращается в гелий 3He.
Двухатомная молекула водорода может находиться в двух состояниях – орто- и пара-. Для пара-водорода спины атомных ядер антипараллельны ↑↓, для орто – параллельны, например так ↓↓. Так называемый обычный водород представляет собой смесь 25% пара- и 75% орто-модификаций. Пара и ортоводород взаимопревращаются, тепловой эффект превращения 1418 Дж/моль. Этот эффект весьма заметен при низких температурах (водород плавится при 14,01 К и закипает при 20,28 К) и должен учитываться при конденсации водорода в промышленных масштабах и при создании ракетных двигателей на жидком водороде.
Электронная конфигурация 1s1.
1.2 Химические свойства. 1.2.1 Электродные потенциалы. Водород в отрицательных степенях окисления сильный восстановитель, в положительной представляет собой слабый окислитель.
Кислая среда
I 0 –I
H3O+ 0,00 H2 –2,25 H-
Щелочная среда
I 0 –I
H2O 0,828 H2 –2,25 H-
Потенциал пары H2/H3O+ как мы помним, принят равным нулю при 298,15 К и давлении водорода 101325 Па. При этом концентрация (точнее активность) ионов водорода равна 1 моль/л. Водородный электрод pH-зависим, его потенциал
E = E0 – 0,059/1·lg[H+] = 0 + 0,059·lg[H+] = -0,059pH.
Пользоваться этим уравнением можно только до pH = 7, при дальнейшем росте показателя концентрация протонов становиться настолько малой, что они уже не влияют на химический процесс.
1.2.2 Свободный элемент. Энергия связи H-H равна 453,6 кДж/моль, что обуславливает изрядную химическую инертность водорода. Со фтором водород реагирует при крайне низких температурах, когда фтор твердый, а водород – жидкий.
Смесь хлора и водорода может долго стоять в прозрачном сосуде, но если рядом зажечь магниевую ленту, дающую достаточно высокоэнергичные кванты света – фотоны, или нагреть сосуд, происходит взрыв. Детально механизм этой реакции мы рассмотрим чуть позже, после §, посвященного кислороду.
Бром с водородом реагирует только при нагревании. Нагревание с йодом требуется столь значительное, что часть продукта разлагается и выход составляет всего 80%, поэтому HI получают косвенными методами. Все реакции протекают по схемам
H2 + Hal2 → 2HHal
H2 + I2 ↔ 2HI
Кислород в стехиометрической смеси с водородом 1:2 образует так называемый гремучий газ. При нагревании происходит взрыв.
2H2 + O2 → 2H2O
Расплавленная сера реагирует с водородом
H2 + S → H2S
Реакцию азота с водородом, с образованием аммиака NH3 мы подробно изучим в дальнейшем. Она протекает при нагревании, под давлением, да еще и катализатор, в виде железа, ей подавай.
N2 + 3H2 (t, P, Fe) ↔ 2NH3
Углерод в элетроразряде (для этого нам нужно просто два графитовых электрода в атмосфере водорода) образует метан
C + 2H2 → CH4
Это простейший представитель тех неисчислимых сонм углеводородов, с которыми мы подробно познакомимся в 10-м классе.
Из других p-элементов плохо реагирует селен, с образованием селеноводорода H2Se и еще хуже теллур. В некоторых источниках встречается идущая с 2% выходом реакция получения фосфина PH3 из элементов, но это для фанатиков исследований, в лаборатории фосфин получают другими методами. Другие p-элементы с молекулярным водородом не реагируют и их соединения получают косвенными методами или же действием атомарного водорода. Взаимодействие с s-, d- и f-элементами и свойства получающихся гидридов мы рассмотрим в соответствующих §§.
1.2.3 Атомарный водород. При воздействии на водород электрического разряда, он переходит в атомарную форму. Атомарный водород также получается по реакциям типа
Zn + 2HCl → ZnCl2 + 2H → ZnCl2 + H2
Если в цинке в качестве примеси содержится сурьма или мышьяк (а это обычно так), то они реагируют с атомарным водородом
As + 3H → AsH3
Получающиеся соответственно арсин или стибин крайне токсичны, поэтому вдыхать получаемый в аппарате Киппа водород нельзя, и, вообще говоря, следует стараться не выпускать его в атмосферу помещений, не оборудованных вытяжным шкафом.
Как мы видим, атомарный водород сильнейший восстановитель, но применение его в таком виде на практике затрудненно. Отметим еще одну особенность. Атомы водорода очень легкие и энергия связи, которая выделяется при образовании молекулы, немедленно приводит к «разбеганию» атомов. Поэтому необходимо стукнуться обо что-то третье и отдать ему излишек энергии. Обозначим третьего как M и тримолекулярная реакция нам обеспечена.
2H + M → H2 + M
Рекомбинация изотопов атомов водорода в молекулы при больших давлениях, протекает на третьих атомах того же самого водорода или уже получившихся молекулах. Это приводит к тому, что в межзвездных пространствах встречаются гигантские облака атомарного водорода. Они разрежены настолько, что найти третьего – пылинку или хотя бы еще один атом, очень трудно. Облака эти часто холодные, поэтому атомы двигаются медленно в пространстве. А когда вас мало и вы случайным образом ползете в разные стороны…
В старой литературе можно найти термин хизон и его формулу H3. На самом деле такое вещество, конечно же, не только не существует, но и не может существовать. Приписываемая ему активность на самом деле обусловлена атомарным водородом.
1.3 Применение и получение. В настоящий момент водород применяется в основном в химической промышленности, как восстановитель металлов средней активности, сопоставимых с железом (железо так не получают в промышленности, если что). Весь получаемый аммиак требует для своего синтеза чистого водорода. В органической химической технологии он и используется и получается в зависимости от требуемых операций и сырья, о чем мы подробнее поговорим в 10-м классе.
Пожароопасность водорода привела к отказу от водородных аэростатов и дирижаблей. Желающие набирают в «интернетах» гибель «Гинденбурга». Странно, что при таком пожаре выжило почти две трети сопричастных – пассажиров и членов экипажа. Невредимым конечно не ушел никто, все получили травмы и ожоги той или иной степени тяжести.
Особенности работы с водородом, пока не позволяют создать компактные двигатели для маломерных технических аппаратов, работающих на нем – например автомобилей. Для надводных кораблей и подводных лодок была найдена альтернатива в лице атомных силовых установок. В ракетно-космической технике водородом заправляют вторую ступень отечественной ракеты-носителя «Энергия». Самолет на водороде так до сих пор и не построен. В самом деле, для эксплуатации такой машины нужно много водорода, а это может себе позволить далеко не каждый аэропорт. Международный аэропорт типа «Нарита» в Токио, это просто гигантский город сам по себе и переоборудовать его под водородное топливо…
Большие объемы водорода получают при паровой конверсии метана
CH4 + H2O (t) → CO + 3H2
Получающийся угарный газ CO, также используется как восстановитель в промышленности. Отделяют его от водорода глубоким охлаждением. Большие объемы водорода получают при электролизе водных растворов различных солей, обычно – в производстве едкого натра (гидроксида натрия) NaOH из поваренной соли (хлорида натрия) NaCl. Получаются сразу три ценных продукта – каустическая сода – гидроксид натрия NaOH, водород и хлор
2NaCl + 2H2O (±) → H2(катод) + 2NaOH + Cl2(анод)
Поваренной соли и воды в природе много, все три продукта нужны, технология безотходная, но требует много электроэнергии.
Галогены – элементы подгруппы фтора.
Астат иногда отделяют от них,
в номенклатурном плане, как элемент не известный
в классической химии до 1940 г.
§2. Фтор.
2.1 Фтор F2. Название в русском языке от фторос –разрушающий, в английском – от флюорита, плавикового шпата CaF2 Фтор представляет собой газ, окрашенный в желтоватый цвет, с резким запахом, довольно трудно сжижающийся. Электронная конфигурация [He]2s22p5.
2.2 Электродные потенциалы F2/F- 2,866 F2/HF2- 2,979 F2/HF 3,053
2.3 Химические свойства. Фтор чрезвычайно ядовит и химически крайне агрессивен (его электроотрицательность наибольшая среди элементов). Это создает значительные трудности в работе с ним, требует специальных навыков и оборудования. Фтор непосредственно взаимодействует практически со всеми элементами вплоть до Es. Исключение составляют гелий, неон и аргон, полностью устойчивые к его действию. Очень плохо взаимодействует азот, тогда как криптон и, в особенности, кислород образуют неустойчивые при комнатной температуре продукты. Более или менее пассивны при н.у. к действию фтора углерод, медь, никель, платина. Большинство же остальных элементов и многие их соединения сгорают в атмосфере этого галогена без предварительного нагревания. Водород взрывается даже в жидком состоянии при соприкосновении с твердым фтором. Продуктами горения являются, как правило, высшие фториды. Исключения составляют оксиды и нитриды (фториды азота и кислорода не образуются), иногда в смеси могут образоваться и низшие фториды (разложение других галогенидов, реже сульфидов и карбидов). Во всех своих соединениях фтор проявляет степень окисления - 1. Некоторые примеры реакций приведены ниже
S + 3F2 = SF6
2Ta + 5F2 = 2TaF5
2H2O + 2F2 = 4HF + O2
n/2O2 + F2 = OnF2
Последняя реакция протекает в смеси жидких элементов (электроразряд), примерно при 80 К, n меняется в диапазоне 2 – 6.
§3 Хлор.
3.1 Физические свойства. Желто-зеленый (что собственно дало название элементу, ср. хлоропласты у растений) газ с резким запахом, чрезвычайно токсичен. Обладает довольно высокой критической температурой (417 К) и может быть превращен в жидкость, уже при обычных температурах при повышенном давлении (~ 76 атм.). Все кто бывал в медицинских учреждениях, знает, как пахнет хлор, но в применяемом там препарате (хлорке или хлорной извести) даже суммарное количество хлора на всю больницу, перемещенное в одну палату сразу после тщательной санобработки, крайне не велико.
3.2 Электродные потенциалы.
Кислая среда
VII V III I 0 -I
ClO4- 1,201 ClO3- 1,181 HClO2 1,701 HClO 1,630 Cl2 1,35828 Cl-
Щелочная среда
VII V III I 0 -I
ClO4- 0,374 ClO3- 0,295 ClO2- 0,685 ClO- 0,421 Cl2 1,35828 Cl-
3.3 Химические свойства. Агрессивный неметалл, реагирует почти со всеми элементами и многими их соединениями. В отличие от фтора, реакция с водородом требует нагревания или освещения
H2 + Cl2 (hν) → 2HCl
Это свободно-радикальный неразветвленный процесс детали, которого мы рассмотрим далее. Получающийся бесцветный газ с резким запахом, в воде (до 450 литров на литр) хорошо растворим, образуя т.н. соляную кислоту, о которой мы поговорим отдельно.
Инертные газы к хлору устойчивы, азот и кислород (последний при криохимии дает специфические продукты) с ним не реагируют. Помимо последних двух элементов хлор электроположителен к фтору, для всего остального в периодической системе он окислитель. Взаимодействие с углеродом мы рассмотрим в §, посвященном химии углерода.
Водный раствор хлора, при охлаждении выделяет газогидрат (клатрат) хлора Cl2·8H2O. Сам по себе раствор, помимо молекул хлора, содержит небольшое количество соляной HCl(aq) и хлорноватистой HClO кислот
Cl2 + H2O ↔ HCl + HClO
Водяной пар разлагается хлором
2H2O(г) + 2Cl2 (t) → 4HCl + O2
В присутствии катализатора (CuCl2) равновесие смещается в сторону образования воды.
При пропускании через растворы гидроксидов получаются смеси соответствующих солей – хлоридов и гипохлоритов. Через раствор NaOH – получается лабарракова вода, через раствор KOH – жавелева вода. Через раствор Ca(OH)2 – хлорная известь или хлорка
Ca(OH)2 + Cl2 → Ca(OCl)Cl + H2O
Хлорка – хлорид-гипохлорит кальция. Используется как обеззараживающее средство для уборки помещений. Гипохлориты также используются для отбеливания тканей, в стиральных порошках (заменяются пероксоборатами), отбеливания бумаги.
Француз Бертолле, который немало работал с хлором, назвал раствор хлора в растворе едкого кали, жавелевой водой – по местечку Жавель, под Парижем, где ее стали изготовлять в промышленных количествах. Впервые лабарракову воду получил француз Лабаррак в 1820-е годы. Ее еще можно получать, пропуская хлор через водный раствор соды.
Na2CO3(aq) + Cl2 → NaCl + NaClO + CO2↑
Но это все работает пока растворы щелочей холодные. Бертолле, недолго (или долго) думая, пропустил хлор через горячий раствор едкого кали. При охлаждении, за счет уменьшения растворимости, из раствора выпал хлорат калия – то, что теперь называют, бертоллетовой солью.
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Хлорат калия при нагревании, диспропорционирует, образуя перхлорат.
4KClO3 (t) → 3KClO4 + KCl
Перхлорат в воде малорастворим и его сравнительно легко отделить от примесей. В присутствии MnO2, при нагревании или трении (оно, кстати, тоже дает нагрев) хлорат калия выделяет кислород. Это используется в спичечной промышленности. Реакцию эту следует знать. Приведем теперь таблицу соответствий для названий кислородных кислот хлора и их солей.
Таблица 3.1
| Формула | Кислота | Соль | Систематическое название |
| Хлорноватистая | HClO | Гипохлорит | Оксохлорат (I) |
| Хлорноватая | HClO2 | Гипохлорат | Оксохлорат (III), диоксохлорат |
| Хлористая | HClO3 | Хлорат | Оксохлорат (V), триокосхлорат |
| Хлорная | HClO4 | Перхлорат | Оксохлорат (VII), тетраоксохлорат |
Хорошо скажете вы, из трех солей, получение которых мы в принципе знаем, мы кислоту как-нибудь сообразим, а где брать хлорноватую? Давайте обработаем хлорат калия концентрированной серной кислотой
4KClO3 + 2H2SO4(конц) →2K2SO4 + 4ClO2↑ + O2 + 2H2O
Выделившийся диоксид хлора при охлаждении димеризуется и образует жидкость состава Cl2O4. Это вещество является типичным смешанным ангидридом
2NaOH + 2ClO2 → NaClO3 + NaClO2 + H2O
Его окисление озоном дает еще один оксид
2ClO2 + 2O3 → Cl2O6 + 2O2
В отличие от оксида хлора (IV) оксид хлора (VI) при обычной температуре димерная жидкость, разлагающаяся до газообразного ClO3 при нагревании. Это также смешанный ангидрид – хлористой и хлорной кислот. С пероксидом бария диоксид хлора дает гипохлорат бария
BaO2 + 2ClO2 → Ba(ClO2)2 + O2
Осадив барий разбавленной серной кислотой, получаем раствор хлорноватой кислоты, выделить которую в чистом виде не удалось.
Хлорную кислоту получают разложением перхлората калия в концентрированной серной кислоте при нагревании
KClO4 + H2SO4 (t) → KHSO4 + HClO4↑
Хлорная кислота – бесцветна, самая сильная кислота в водных растворах. На свету и из-за попадания пыли темнеет. Перегонять следует аккуратно, кислота может взрываться с разложением. Для безводной кислоты известна специфическая реакция
H3PO4(т) + HClO4 → P(OH)4ClO4
Поможет нам фосфор и в другой реакции
P2O5 + 2HClO4 → 2HPO3 + Cl2O7
Гептаоксид хлора бесцветная жидкость, сильный окислитель. При нагревании разлагается на элементы.
Наконец, Cl2O – газ, получаемый по реакции
2Cl2 + HgO → HgCl2 + Cl2O
Растворением его в воде можно получить разбавленный раствор хлорноватистой кислоты.
§4. Бром, йод, астат.
4.1 Физические свойства. Бром (от греческого bromos - зловоние), тяжелая темно-бурая жидкость. Электронная конфигурация [Ar]3d104s24p5. Пахнет не «Шанель №5» лекционную аудиторию, рассчитанную на 150 человек, ароматизирует практически мгновенно из открытой банки с горлышком диаметром в несколько сантиметров. Работать строго под тягой! В воде растворяется незначительно, намного лучше в органических растворителях. Йод (собственно с греч. фиолетовый, [Kr]4d105s25p5) – фиолетово-черные кристаллы с металлическим блеском, практически не растворим в воде. Если йод не нагревать, то он никуда не полетит, но все же лучше работать с ним под тягой. При нагревании йод переходит в газ, минуя жидкое состояние (плавится под давлением) – возгоняется.
Астат (гр. неустойчивый, [Xe]5d104f146s26p5) сильно радиоактивен, период полураспада его искусственных изотопов, 210At – 8,1 ч, 211At – 7,2 ч. Содержащиеся в незначительных количествах в урановых и ториевых рудах изотопы распадаются не более, чем за 2 с. Химия астата изучена на микроколичествах элемента.
4.2 Электродные потенциалы приведены на схемах
Кислая среда
VII V I 0 –I
BrO4- 1,853 BrO3- 1,447 HBrO 1,604 Br2 1,0652 Br-
H5IO6 1,6 IO3- 1,13 HIO 1,44 I2 0,535 I-
HAtO3 1,4 HAtO 0,7 At2 0,2 At-
Щелочная среда
VII V I 0 –I
BrO4- 1,025 BrO3- 0,492 BrO- 0,455 Br2 1,0652 Br-
H3IO62- 0,65 IO3- 0,15 IO- 0,42 I2 0,535 I-
AtO3- 0,5 AtO- 0,0 At2 0,2 At-
Как видно из схемы, по мнемоническому правилу – потенциал справа больше потенциала слева кислая среда не благоприятна для диспропорционирования, и кислоты в растворах брома и йода мало. В щелочной наоборот, и, кроме того, при нагревании значительно легче хлора образуются броматы и иодаты (V).
4.3 Химические свойства. 4.3.1 Простые элементы и галогениды. Электроотрицательность брома (2,96) по Полингу уступает хлору незначительно, однако заметно больший радиус атома может приводить к тому, что соответствующие высоковалентные производные брома получить заметно труднее. Поэтому, если у атома-партнера есть несколько степеней окисления, то бромиды фиксируются в более низковалентной форме, чем хлориды. Тоже касается и йода. Он еще менее активен (2,66) и обладает немалыми размерами. Наиболее ярко это проявляется в галогенидах рения. Получены были ReF7, ReCl6, ReBr5 и ReI4. Пентабромид рения малостоек и существует только в избытке брома, поскольку разлагается по реакции
3ReBr5 ↔ Re3Br9 + 3Br2
Но о галогенидах рения в другом месте.
HBr (бромоводородная кислота) и HI (иодоводородная) могут быть сконцентрированы до концентрации 47% и 57% массовых соответственно. Это очень удобно для запоминания (соляная до 37%). Обе кислоты сильные и могут использоваться для всяких полезностей в органической практике – с одной стороны сильные, с другой при этом не окислители. HI необходимо хранить в темных стеклянных бутылях с небольшой присадкой красного фосфора. В этом случае протекает система реакций
4HI + O2 (hν) → 2I2 + 2H2O
2P + 3I2 → 2PI3
PI3 + 3H2O → H3PO3 + 3HI
Со структурой фосфористой кислоты мы ознакомимся в соответствующем параграфе, для себя же отметим, что она сама по себе восстановитель и тем самым по прежнему выполняет протекторную функцию. Если вы гонитесь за чистотой HI или вам нужна особо чистая HBr, то и тут нам поможет фосфор. Получаем его иодид или бромид прямой реакцией элементов, заливаем водой и перегоняем раствор. H3PO3 и ортофосфорная H3PO4, которая получается при доступе к первой воздуха (или если мы переусердствовали и получили PBr5), в условиях отгонки наших кислот, не летучи. Использовать концентрированную серную кислоту для получения водородных производных нельзя
2H2SO4(конц.) + 2NaBr → Na2SO4 + Br2 + SO2 + 2H2O
2H2SO4(конц.) + 2NaI → Na2SO4 + I2 + SO2 + 2H2O
В литературе можно встретить реакцию
2H2SO4(конц.) + 8NaI → Na2SO4 + I2 + H2S + H2O
Но у нее имеется целый букет побочных процессов
I2 + H2S → 2HI + S↓
S + 2H2SO4 → 3SO2 + 2H2O
H2S + 3H2SO4 → 4SO2 + 4H2O
Первой из них можно пользоваться для получения разбавленных растворов HI, а серу просто отфильтровать. Получение HI из элементов затрудняется заметной (выход HI всего 80%) обратимостью реакции.
Взаимодействие йода и порошка алюминия при обычных условиях не наблюдается. Но выясняется, что вода в этой реакции является катализатором
2Al + 3I2 (H2O) → 2AlI3
Демонстрационная работа. Достаточно капнуть в смесь элементов воды из пипетки, как реакция понесется мамонтом по тундре. Только что он был в лед вморожен, а тут помчался, на вертолете не догонишь. Теплота реакции столь велика, что возгоняющийся йод образует очень красивое темное облако. Поскольку йод в парах не полезен для здоровья, реакцию проводят в вытяжном шкафу.
Комплексообразование для бромид- и иодид-ионов характерно в меньшей степени, чем у более легких аналогов. Сами эти ионы заметно больше хлорид- и фторид-ионов (т.н. стерические/геометрические препятствия), а эффективный заряд на них заметно меньше, что ослабляет электростатическое взаимодействие. Однако, доля ковалентной связи центрального иона с лигандом возрастает и для малоактивных металлов устойчивость комплексов с ростом атомного номера галогена растет. Например, в однотипном ряду
PtI42- > PtBr42- > PtCl42- >> PtF42-
или в реакции
K2PtCl6 + 6KBr → K2PtBr6 + 6KCl
Для многих активных элементов наоборот, фторидные комплексы намного устойчивее остальных. Например, полученный взаимодействием безводных хлоридов NaAlCl4 не стоек к воде
NaAlCl4 + 6H2O → NaCl + AlCl3·6H2O
Гексафторалюминат натрия Na3AlF6 – природный минерал криолит.
Помимо классических комплексов, йод образует специфические полииодиды. Как известно, то, что в быту называется йод, это отнюдь не йод и даже не его спиртовая настойка. С этиловым спиртом свободный йод немедленно реагирует
CH3CH2OH + I2 → CH3CHO + 2HI
А если рядом CH3 и C=0 группа, то немедленно протекает йодоформная реакция
2СH3COH + 7I2 + 2H2O → 2CHI3↓ + 2CO2 + 8HI
Выпадает желтый осадок йодоформа. Все подробности этой реакции мы рассмотрим в 10-м классе, нам же достаточно знать, что из обыденных веществ такую реакцию дает ацетон (CH3)2CO. Нужно также понимать, что этиловый спирт C2H5OH никогда не бывает безводным – кроме случаев, когда мы получаем абсолютный спирт. Во избежание разложения раствора йода, его связывают в комплекс с иодидом калия
KI + I2 → KI3
Для тех целей, в которых используется спиртовая настой йода (прижигание и обеззараживание ран), равновесная концентрация йода достаточна. Кристаллическим йодом раны прижигать нельзя!
Триодид-ион линейный, [I-I+I-]-. Известны и более сложные ионы, I5-, I7- и I9-. нелинейного строения. Все они образуются за счет перекрывания заполненных p- и вакантных d-орбиталей.
Поведение бромидов и иодидов по отношению к воде сходно с хлоридами. AgCl белый, AgBr желтоватый, AgI желтый. Их растворимость в воде уменьшается.
4.3.2 Кислородные производные. Для получения раствора бромноватистой кислоты используется следующая хитрая реакция
Ag2SO4 + Ba(OH)2 + 2Br2 → 2AgBr↓ + BaSO4↓ + 2HBrO
Кислота эта перегонкой под уменьшенным давлением, при +30 0С может быть сконцентрирована до 30%. HIO получить в растворе, без примесей, не удалось.
В органическом растворителе пиридине (Py или 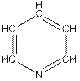 ), по следующей реакции могут быть выделены оксиды (I)
), по следующей реакции могут быть выделены оксиды (I)
[Ag(Py2)]2O + 2I2 → 2AgI↓ + I2O·4Py
Br2O – нестойкий бурый газ, получаемый из элементов в электроразряде, выше 0 0С разлагающийся. Другой продукт BrO2 еще менее устойчив, и выше -40 0С распадается на элементы. В литературе также можно найти упоминания о Br2O3, BrO3 и Br3O8, с температурами разложении не выше 200 К. Последний состав вероятнее всего отвечает смеси оксидов.
Бромноватая кислота HBrO2 в растворе диспропорцонирует. Ее литиевую соль можно получить осторожным разложением бромата лития
2LiBrO3 (200 0C) → 2LiBrO2 + O2 (225 0C) → 2LiBr + 3O2.
Соответствующая кислота йода не получена, трихлорид йода при водном гидролизе дает мгновенно диспропорционирующий продукт.
3ICl3 + 6H2O → 2HIO3 + HI + 9HCl
В степени окисления 3+, для йода были выделены некоторые солеподобные соединения – сульфат, нитрат и иодат (V) I(IO3)3.
Соли бромистой кислоты получают аналогично солям хлористой. В отличие от них обеих, HIO3 может быть выделена в свободном состоянии, а ее раствор легко получить по реакции
I2 + 10HNO3 (конц.) → 2HIO3 + 10NO2 + 4H2O
При 275 0С это твердое вещество обезвоживается, образуя I2O5, разлагающийся, свыше 300 0C, на элементы.
При окислении иодатов (V) получаются ортоиодаты
2KIO3 + 6KOH + 2Cl2 → 2K2H3IO6 + 4KCl
Ортойодная кислота твердая, в водном растворе получены тригидрогексаоксойодаты (VII), например K2H3IO6. Сообщалось, что действием олеума (раствор SO3 в чистой H2SO4) на нее, может быть получен твердый I2O7, но это сомнительно. Средние растворимые соли, получаемые сплавлением со щелочами, сильно гидролизованы по 4-й и тем более 5 ступени диссоциации кислоты. Соли многозарядных катионов, например Ba5(IO6)2 нерастворимы.
Для получения перброматов нужен окислитель посерьезнее, фтор или фториды инертных газов, с помощью которых они были впервые получены
KBrO3 + XeF2 + H2O → KBrO4 + Xe + 2HF
HBrO4 в чистом виде получить не удалось, ее концентрированные растворы взрывоопасны.
4.4 Астат ( [Xe]4f145d106s26p5). Высочайшая радиоактивность вкупе с малыми периодами полураспада – основное препятствие при изучении этого элемента. Известно, что он образует астататы (V), а высшие степени окисления не были получены, как и кислородные соединения (III). Нерастворимы AgAtO3, AgAt. Был также получен нерастворимый сульфид астата At2S. Все исследования проводились на индикаторных количествах элемента.
§5. Галогенводороды.
5.1 Определение. Галогенводородами называют соединение водорода с галогенами, HHal. Рассмотрим подробнее некоторые свойства HF и HCl.
5.2 Фтороводород HF. Фтороводород (фтористый водород) – бесцветный газ с резким запахом, при 293 К конденсирующийся в бесцветную подвижную жидкость. Водородные связи в HF настолько сильны, что одно время предлагалось писать его формулу в виде H2F2. Характерны и более крупные образования – вплоть циклических гексамеров H6F6. За счет водородных связей стабилизируются ионы типа HnFn+1-. Наиболее устойчивый и известный из них HF2-. Ион гидродифторида линейный, с атомом водорода в центре, связи между атомами фтора и атомом водорода выровнены.
Специфической особенностью фтороводорода и его водных растворов (плавиковой или фтористоводородной кислоты, продажный раствор содержит 40% массовых), является разложение силикатов и оксида кремния
Na2SiO3 + 6HF = Na2SiF6 + 3H2O
SiO2 + 4HF = SiF4↑ + 2H2O.
Гексафторкремниевая кислота H2SiF6 частично образуется в растворе при реакции между тетрафторидом кремния и избытком фтороводорода, но не может быть выделена из раствора в чистом виде. Это обусловлено тем, что два атома фтора в ионе SiF62- связаны с атомом кремния донорно-акцепторными связями (хотя, указать какие именно два атома из шести, конечно, невозможно). Образование же ионного кристалла с протонами в узлах кристаллической решетки энергетически невыгодно.
Другой особенностью фторида водорода, является трудности с его обезвоживанием. Из-за неограниченной смешиваемости с водой, HF не так-то просто выделить в чистом виде (его осушают электролизом). Кроме того, фтороводород реагирует с подавляющим большинством осушителей, такими, как серная кислота, оксид фосфора (V) и хлорид кальция.
H2SO4 + HF ↔ HSO3F + H2O
P2O5 + 3HF → H2PO3F + HPO2F2
CaCl2 + 2HF(ж) → CaF2 + 2HCl↑
Первая реакция, как мы видим, обратима, вторая приводит к образованию фторфосфорных кислот. Наибольший интерес представляет реакция с хлоридом кальция. Рассмотрим чуть более подробно поведение плавиковой кислоты в зависимости от ее концентрации. В разбавленном водном растворе HF является слабой кислотой, что является следствием прочной связи атомов – перенос протона на молекулу воды и возникновение пространственного разделения зарядов не выгодно. Наоборот, жидкий HF является суперкислотой. Подробнее тему суперкислот, мы разберем в отдельном §, после рассмотрения серной кислоты, которая также является представителем этого класса веществ. Кроме того, хлороводород в жидком HF не растворим и реакция смещается вправо.
Получают HF обычно из фторида кальция (минерал флюорит или плавиковый шпат) по реакции
CaF2 + H2SO4(конц) (t) → CaSO4 + 2HF↑
В лаборатории его хранят в пластиковой таре. Можно использовать и стеклянную посуду, покрытую слоем парафина, как это делали в прошлом, когда с пластмассой было плохо.
Если мы хотим сделать матовый рисунок на стекле, то накладываем на него нерастворимый в кислотах трафарет, по вырезам насыпаем CaF2 и смачиваем концентрированной серной кислотой.
Фтороводород ядовит, при работе с ним необходимо пользоваться вытяжным шкафом. За счет летучести он разрушает зубы, попадание на кожу на первый взгляд не заметно. Позднее развивается болезненный и плохо заживающий абсцесс.
Большинство фторидов металлов, как правило, нерастворимы или малорастворимы. Очень хорошо растворимы фториды щелочных металлов, аммония и серебра. Фторид кальция наоборот растворим плохо.
5.3. Хлороводород. В отличие от HF, HCl – бесцветный газ, хорошо растворимый в воде, в которой образует, с максимальной концентрацией 37%, сильную соляную кислоту. Старым лабораторным способом его получения был нагрев поваренной соли с серной кислотой.
NaCl + H2SO4(конц.) (t) → NaHSO4 + HCl
Сейчас значительные количества соляной кислоты могут быть получены из хлора и водорода, побочных продуктов производства NaOH
2NaCl + 2H2O (±) → H2↑ + 2NaOH + Cl2↑
H2 + Cl2 → 2HCl
Поскольку химической промышленности нужны хлоруглеводороды, для различных целей, а для их получения зачастую требуется свободный хлор, то огромное количество хлороводорода является побочным продуктом в органическом синтезе.
CH4 + Cl2 (t) → CH3Cl + HCl
Подробнее каталепсию (замещение водорода на хлор) метана мы рассмотрим в 10-м классе. Часть химики-органики оставляют себе, на получение, например, винилхлорида CH2=CHCl, остальное забирают другие химики для иных деяний.
Соляная кислота (в просторечии солянка, учись правильным жаргонизмам!) сильная, ее соли хлориды, как правило, растворимы. Нерастворимы монохлориды металлов подгруппы меди, каломель – Hg2Cl2, малорастворим PbCl2. Галогениды свинца вообще мало растворимы, особенно это касается хлорофторида PbClF и ярко-желтого PbI2.
Хлорид-ион – сравнительно хороший комплексообразователь,
Соляная кислота содержится в организме человека – в желудке, где создает кислую среду, необходимую для расщепления компонентов пищи на более простые блоки. Если вас хорошо будут учить анатомии, то в 9-м классе расскажут про это подробно. Если плохо, то в 10-11 классе, об этом вы узнаете в продолжении этой книги. Или опять же на уроках общей биологии.
Смесь концентрированных соляной и азотной кислот в соотношении 3:1 – царская водка. Мы с ней обязательно встретимся при изучении азотной кислоты, золота и платиновых металлов.








