1- Орбиталь 1S (сферическая)
Билеты по химии
I билет: Строение атомов 1-3 периодов. Состав атомов, изотопы, электронное строение атомов.
4+2He:
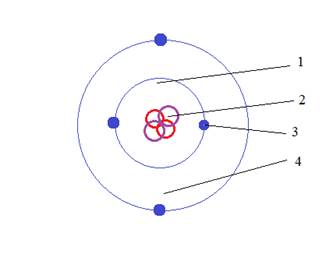
1- Орбиталь 1S (сферическая)
2- Ядро
3- Электрон
4- Орбиталь 2S (сферическая)
Атом – система, состоящая из ядра и электронов, связанных малыми энергиями.
Ядро – система из протонов и нейтронов, связанных большими энергиями.
Электрон – и частица, и волна одновременно; как частица имеет массу, как волна способен распространяться во все стороны от ядра в одно и то же время.
Электронное облако – часть пространства вокруг ядра, куда распространяются электроны.
Электронная орбиталь – часть электронного облака, вероятность нахождения электронов в которой максимальна.
Изотопы – вид атомов с одинаковым зарядом ядра, но разным массовым числом.
Сколько электронов в орбитали максимум: S – 2, P – 6, d – 10, f– 14.
Порядок заполнения орбиталей: 1S 2S 2P 3S 3P 4S 3d 4P 5S 4d 5P 6S 4f 5d 6P 7S 5f 6d 7P
Дополнение по квантовой теории: см. Приложение 01.
II билет: Периодический закон (ПЗ) и периодическая система элементов (ПС). Современная формулировка периодического закона. Структура периодической системы. Периодичность в строении и свойствах элементов, простых веществ, высших оксидов, гидроксидов и водородных соединений.
Строение и свойства элементов находятся в периодической зависимости от атомной массы элементов.
Современная формулировка ПЗ: Строение и свойства элементов, простых веществ, сложных веществ находятся в периодической зависимости от заряда ядра.
ПС состоит из групп и периодов.
Группа – вертикальный столбец элементов-аналогов по электронному строению наружного электронного уровня.
Период – горизонтальная строка элементов, которая начинается с щелочного металла и заканчивается инертным газом.
Группы делятся на главные и побочные.
Главные подгруппы образуют S- и P-элементы, побочные – d-элементы.
f-элементы вынесены за пределы ПС.
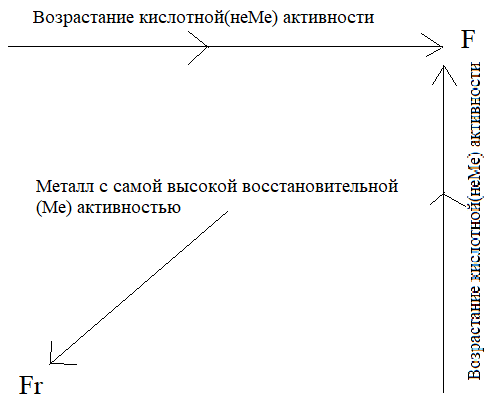
В каждой группе, главной подгруппе, с ростом заряда ядра:
1) Радиус атома увеличивается
2) Электроотрицательность падает
3) Энергия ионизации уменьшается
4) Металлическая/восстановительная активность увеличивается, неметаллическая/окислительная – уменьшается.
В каждом периоде с ростом заряда ядра:
1) Радиус атома уменьшается
2) Электроотрицательность повышается
3) Энергия ионизации увеличиавется
4) Металлическая/восстановительная активность уменьшается, неметаллическая/окислительная – увеличивается.
У высших оксидов/гидроксидов чем активнее элемент-металл (элемент-неметалл), тем основнее (кислотнее) у него высшие оксиды/гидроксиды
| I A | II A | III A | IV A | V A | VI A | VII A |
| R2O | RO | R2O3 | RO4 | R2O5 | RO6 | R2O7 |
| RH4 | RH3 | H2R | HR |
| В периоде | В группе | |
| Металлические свойства простых веществ | Падает | Растет |
| Основаные свойства высших оксидов и гидроксидов | Падает | Растет |
| Основные свойства водородных соединений | Падает | – |
| Неметаллические свойства простых веществ | Растет | Падает |
| Кислотные свойства высших оксидов и гидроксидов | Растет | Падает |
| Кислотные свойства водородных соединений | Растет | – |
III билет: Определение по строению атомов и положению элемента в ПС валентности и степени окисления элементов.
СТОК – условный заряд элемента, который он приобрел бы, отдав/приняв электроны.
Валентность – количество ковалентных связей, которые может образовать элемент.
! Элементы, начиная с 3 периода – все имеют возбужденное состояние
Определение валентности по строению атома:
Если у атома есть возбужденное состояние, то валентность определяется числом неспаренных электронов в основном и возбужденном состоянии атома.
Если у атома нет возбужденного состояния, то валентность определяется числом неспаренных электронов плюс числом электронных пар в основном состоянии атома.
Определение валентности по положению элемента в ПС:
Если у атома есть возбужденное состояние, то валентность определяется номером группы.
Если у атома нет возбужденного состояния, то валентность определяется номером группы минус один (в случае с литием и водородом валентность равна I).
Отрицательные степени окисления есть только у неметаллов.
Определение СТОК по строению атома:
Положительная СТОК: число неспаренных электронов в основном и возбужденном состоянии атома.
Отрицательная СТОК: число неспаренных электронов в основном состоянии атома, взятое с противоположным знаком
Определение СТОК по положению элемента в ПС:
отр.СТОК(Х) = Nгруппы(Х) – 8
пол.СТОК(Х) = Nгруппы(Х)
Исключения из всего вышеуказанного:
1) Инертные газы. Валентность и СТОК у них всегда равны 0.
2) СТОК(F) 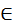 {0; −1}
{0; −1}
3) СТОК(O) 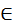 {−2; −1; 0; 1; 2}
{−2; −1; 0; 1; 2}
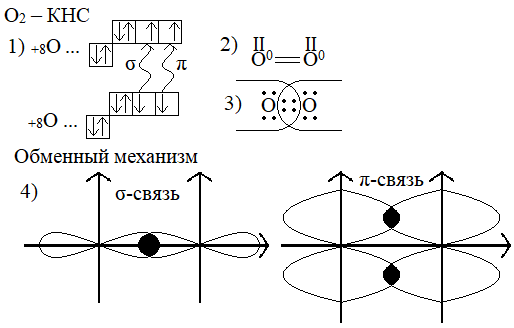
4) ВАЛ(O) 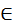 {2}
{2}
5) ВАЛ(F) 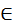 {1}
{1}
Существуют, как правило, характерные СТОК, они находятся в интервале между максимальной СТОК и минимальной СТОК и идут с шагом 2.
IV билет: Виды химической связи. Определения, когда образуются, сравнительная прочность. Определение вида химической связи по формуле вещества
Химическая связь – сила, удерживающая вместе атомы/молекулы/ионы или любую комбинацию из этих частиц. Природа – электростатическое притяжение. Образование выгодно по энергии.
Виды:
· Ковалентная
· Металлическая
· Ионная
· Водородная
· Межмолекулярная
Ковалентная химическая связь – такая химическая связь, которая образована между либо двумя и более атомами-неметаллами, либо между двумя и более атомами металла и неметалла, разница в электроотрицательности которых менее 2 (СТОК металла более 4) за счет притяжения ядер атомов к общей электронной паре.
Металлическая химическая связь – такая химическая связь, которая образована между атомами металлов в металлах и сплавах металлов за счет электростатического притяжения ядер атомов металлов к свободно перемещающимся электронам.
Ионная химическая связь – такая ХС, которая образована между атомами металла и неметалла – электростатическое притяжение катионов и анионов. Возникает между атомами с разностью электроотрицательностей >2 (СТОК металла меньше 4 включительно), при которой общая электронная пара переходит преимущественно к атому неметалла.
Межмолекулярная связь – связь между любыми молекулами, имеющая электростатическую природу, чем больше молекула, тем короче межмолекулярная связь.
Водородная связь – связь между молекулами (или внутри длинной молекулы), образующаяся между атомами водорода и F, O и N.
Прочность:
Самые прочные – ковалентная связь, ионная связь, металлическая связь.
Непрочная – межмолекулярная связь.
Чуть более прочная, чем межмолекулярная – водородная связь.
Определение типа связи по формуле вещества:
Если как минимум два атома в молекуле неметаллы – это КС, полярная – если молекулу составляют атомы разных элементов, неполярные – если молекулу составляют атомы одного элемента. Также внутри молекулы КПС, если есть атом металла со СТОК более 4 и атом неметалла.
Если есть атом металла со СТОК менее 4 включительно и атом неметалла, то это ИС.
Если в молекуле только атомы металла – это металлическая связь.
Связь между любыми молекулами молекулами – межмолекулярная.
Если в молекуле присутствует атомы H и F, O, N – это водородная связь (также между молекулами на вышеупомянутых условиях).
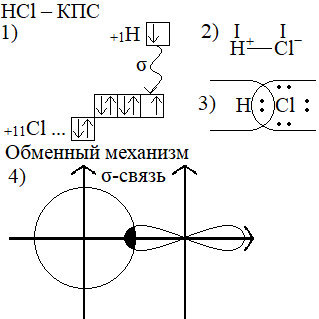
V билет: Ковалентная связь. Классификация, параметры. Запись образования ковалентной связи на примере ковалентной полярной связи и ковалентной неполярной связи
Ковалентная химическая связь – такая химическая связь, которая образована между либо двумя и более атомами-неметаллами, либо между двумя и более атомами металла и неметалла, разница в электроотрицательности которых менее 2 (СТОК металла более 4) за счет притяжения ядер атомов к общей электронной паре.
· Ковалентная связь бывает полярная (КПС), и неполярная (КНС).
· Ковалентная связь бывает одинарная, двойная, тройная etc.
· Существуют ковалентные σ(сигма)-связи и π(пи)-связи.
· Ковалентная связь бывает образована по обменному или донорно-акцепторному механизму.
КПС – КС между атомами разных элементов.
КНС – КС между атомами одного элемента.
σ-связь образована лобовым перекрыванием электронных облаков вдоль линии соединения центров ядер атомов. Если ковалентная связь одна – она ВСЕГДА σ.
π-связь образуется боковым перекрыванием P-электронных облаков, удалена от линии соединения центров ядер атомов и разделена в пространстве на 2 зоны.
Обменный механизм – общая электронная пара содержит электрон как от одного атома, так и от другого.
Донорно-акцепторный механизм – общая электронная пара образована из электронной пары одного атома.
Параметры КС:
1) Длина связи l – межъядерное расстояние, чем короче, тем прочнее.
2) Энергия связи Eсв, образования связи – выделяется, разрушение – поглощается
3) Насыщенность связи (определяется валентностью)
4) Направленность связи (определяется видом гибридизации)
Гибридизация – модель электронных облаков по формуле и энергии, приводящая к их энергетической равноценности.
VI билет: Кристаллические решетки веществ. Определение вида кристаллической решетки по формуле вещества. Общие физические свойства вещества по виду кристаллической решетки. Примеры формул веществ для всех видов кристаллических решеток.
Вещества с кристаллическими решетками имеют строгий порядок в расположении частиц.
Место, где находится частица, называется узлом кристаллической решетки.
I. По геометрии кристаллической решетки
1) Кубические (e.g. NaCl)
2) Гексагональные (e.g. H2O)
3) Ромбические
4) Моноклинные
II. По виду частицы в узлах кристаллической решетки
1) Атомные
2) Ионные
3) Металлические
4) Молекулярные
| Вид кристаллической решетки | Связи между узлами | Прочность этих связей | Общие физические свойства | Примечания |
| Атомная, в узлах атомы неметаллов* | КНС или КПС | Самые прочные (короткие) | Твердые, тугоплавкие, нелетучие, нерастворимые в воде | * – B, C, Si, As, Se, Te, (Sb), SiO2 |
| Ионная, в узлах ионы металлов и неметаллов | Ионная | (Очень) прочная | Твердые, тугоплавкие нелетучие, часто хорошо растворимые в воде | Вещества, образованные Ме≤ +4 + неМе e.g. CaO |
| Металлическая, в узлах атомы металлов | Металлическая | Прочная | Металлический блеск, тепло- и электро- проводность, ковкость, пластичность, нелетучие | Металлы, сплавы металлов e.g. Zn |
| Молекулярная, в узлах молекулы | Межмолекулярная (иногда – водородная) | Непрочная | Летучие, легкоплавкие | Все остальные, кроме первых трех e.g. CO2 |
VII билет: Кислород. Характеристика элемента и простого вещества. Строение, получение, свойства. Воздух. Состав воздуха.
Элемент O
16+8O 17+8O 18+8O
M(O) = 15,99 г/моль
+8O 1S2 2S2 2P4
+8O … 2S2 2P4
+8O … 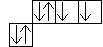
Валентности O – II; III; IV
СТОК(O) – -2, -1*, 0, +1**, +2*** (последние – только с F)
* – H2O2; KO2–⅟₂
** – F2–O2+ – дифторид диоксигена (фторид кислорода (I))
*** – F2–O+2 – дифторид монооксигена (фторид кислорода (II))
Кислород – самый распространенный элемент на земле.
Простые вещества:
· O2 – кислород
· O3 – озон
· O4 – тетракислород
· O5 – пентакислород
M(O2) = 32 г/моль
M(воздуха) = 29 г/моль
D(O2)возд. = 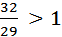 , следовательно, чистый O2 осаждается на дно пробирки с воздухом
, следовательно, чистый O2 осаждается на дно пробирки с воздухом
O2 поддерживает горение.
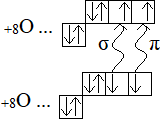
Кислород парамагнитен – втягивается в магнитное поле.
Кристаллическая решетка – молекулярная.
Реальные свойства: летучий, легкоплавкий, без запаха, бесцветный; ограниченная растворимость в воде: в 100V H2O 3V O2.
Воздух (по объему):
1. N2 – 78%
2. O2 – 21%
3. Ar – 1%
4. Прочие – ⁓1%
Способы получения:
I. Промышленный: из жидкого воздуха.
II. Лаборатория – реакции разложения:
1) O3 → O2 + [O]
2) 2H2O ⸺(электролиз)> 2H2 + O2
3) 2H2O2 → 2H2O + O2
4) 2KMn+7O4 → MnO2 + K2MnO4 + O2
5) 2KClO3 → 2KCl + 3O2
6) [Me]NO3 ┬──в РСЭП левее Mg> [Me]NO2 + O2 ` ├──в РСЭП от Mg* до Cu*> [Me]O + NO2 + O2 ` └──в РСЭП правее Cu> [Me] + NO2 + O2
* – Оба включительно.
VIII билет: Водород. Характеристика элемента и простого вещества. Строение, получение, свойства.
Элемент H
1+H; 2+H; 3+H
ē(H) = 1
p(H) = 1
n(H) · 0, 1, 2
M(H) = 1 г/моль
+1H 1S1
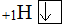
Водород – самый распространенный элемент во Вселенной, на Земле в естественных условиях – простого вещества нет, H2O – самое распространенное соединение водорода.
M(H2) = 2 г/моль
D(H2)возд. = 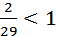 , следовательно, H2 поднимется на дно перевернутой пробирки.
, следовательно, H2 поднимется на дно перевернутой пробирки.
Реальные свойства: легкоплавкий, летучий, бесцветный, без запаха, плохо растворим м воде.
Способы получения:
I. Промышленность: 2H2O ⸻(эл-во)> 2H2 + O2
II. В лаборатории:
1) [акт.Me/Al] + H2O → [Me]OH + H2
2) [Me до Pb в РСЭП] + [кислота, кроме HNO3] → [Me][кислотный остаток] + H2
IX билет: Оксиды – определение, примеры. Способы получения
Оксид – бинарное соединение, состоящее из атома (атомов) любого элемента, кроме F и O, и атома (атомов) O, при этом отрицательная СТОК – у последнего (последних). Пример – BaO, Al2O3, P2O5, NO.
Способы получения:
I. Горение простых веществ в O2.
e.g 2Mg + O2 → 2MgO
4P + 5O2 → 2P2O5
1) Неметаллов.
e.g 2C + O2 → 2CO
2) Металлов.
e.g 4Al + 3O2 → 2Al2O3
Исключения:
Благородные металлы, неметаллы VII A подгруппы (кроме F) не реагируют с O2.
N2 + O2 ⸻(>1500oC или Pt)> 2NO
S + O2 → SO2
Na + O2 → Na2O2
K + O2 → KO2−⅟₂ – супероксид калия (все элементы I A подгруппы ниже – аналогично).
Fe + O2 → Fe3O4: FeO·Fe2O3
II. Горение сложных веществ в O2.
При горении сложных веществ в O2 образуются оксиды элементов, входящих в состав этих сложных веществ.
e.g. C3H8 + 5O2 → 3CO2 + 4H2O
III. Доокисление оксидов (только с промежуточными СТОК элементов).
e.g. 2CO + O2 → 2CO2
IV. Разложение неустойчивых сложных веществ.
1) Нерастворимых оснований и амфотерных гидроксидов.
e.g. Cu(OH)2 → CuO + H2O
Fe(OH)3 → Fe2O3 + H2O
2) Неустойчивых кислот.
H2CO3 → CO2 + H2O (всегда и сразу)
H2SO3 → SO2 + H2O (при нагревании)
H2SiO3 → SiO2 + H2O
4HNO3 (конц.) → 4NO2 + 2H2O + O2
3) Разложение солей неустойчивых кислот.
Соли металлов I A подгруппы ниже лития, кроме нитратов, неразложимы.
e.g. CaCO3 ⸻(800oC)> CaO + CO2
X билет: Классификация оксидов. Определения. Химические свойства основных оксидов.
Оксиды бывают основными, амфотерными, кислотными или несолеобразующими.
Основный оксид – такой оксид, в формуле которого есть кислород и металл со степенью окисления не выше 2 (кроме ZnO, PbO, SnO, BeO). Пример – CaO, CuO, Li2O.
Амфотерный оксид – такой оксид, в формуле которого есть кислород и металл со степенью окисления не ниже 3 не выше 4 (и вышеупомянутые исключения). Пример – Fe2O3, ZnO, SnO2.
Кислотный оксид – такой оксид, в формуле которого есть кислород и металл со степенью окисления не ниже 5 или неметалл (кроме NO, CO, N2O). Пример – CO2, Mn2O7, SO3.
Несолеобразующие оксиды – оксиды-исключения из кислотных оксидов. Пример – NO, CO, N2O.
Химические свойства основных оксидов:
1) Реакция с H2O:
[Me]O + H2O → [Me]OH, в данном случае [Me] – активный металл из I A или II A подгруппы ниже Mg
e.g. BaO + H2O → Ba(OH)2
Исключение:
MgO + H2O ⸻(нагревание)> Mg(OH)2
2) Реакция с амфотерным оксидом:
[амфотерный оксид] + [основный оксид*] → [соответствующая амф.о. соль]
e.g. ZnO + K2O → K2ZnO2
* – оксид только активного металла.
3) Реакция с кислотным оксидом:
[основный оксид] + [кислотный оксид] → [соответствующая к.о. соль]
e.g. K2O + SO3 → K2SO4
4) Реакция с кислотами:
[основный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
e.g. CaO + 2HCl → CaCl2 + H2O
XI билет: Химические свойства амфотерных и кислотных оксидов.
Химические свойства амфотерных оксидов:
0) Амфотерные оксиды не реагируют с H2O
1) Реакция с основным оксидом:
[амфотерный оксид] + [основный оксид*] → [соответствующая амф.о. соль]
e.g. ZnO + K2O → K2ZnO2
* – оксид только активного металла.
2) Реакция с кислотным оксидом:
[амфотерный оксид] + [кислотный оксид] → [соответствующая к.о. соль]
e.g. Al2O3 + 3SO3 → Al2(SO4)3
3) Реакция с щелочью:
[амфотерный оксид] + [щелочь] ⸻(расплав)> [соответствующая амф.о. соль] + H2
e.g. BeO + 2KOH → K2BeO2 + H2
[амфотерный оксид] + [щелочь] + H2O ⸻(раствор)> [соответствующая амф.о. комплексная соль]
e.g. 2NaOH + ZnO + H2O → Na2[Zn(OH)4]
4) Реакция с кислотой:
[амфотерный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
e.g. PbO + 2HCN → Pb(CN)2 + H2O
5) Реакция с солью:
Менее летучие амфотерные оксиды вытесняют в расплаве более летучие амфотерные/кислотные оксиды из соли
[амфотерный оксид] + [соль] → [соответствующая амф.о. соль] + [оксид, соответствующий кислотному остатку соли]
e.g. CaCO3 + Al2O3 → Ca(AlO2)2 + CO2
Химические свойства кислотных оксидов:
1) Реакция с H2O:
[кислотный оксид*] + H2O → [соответствующая к.о. кислота]
e.g. SO3 + H2O → H2SO4
* – кроме SiO2
2) Реакция с основным оксидом:
[кислотный оксид] + [основный оксид] → [соответствующая к.о. соль]
e.g. P2O5 + 3Rb2O → 2Rb3PO4
3) Реакция с щелочью:
[кислотный оксид] + [щелочь] → [соответствующая к.о. соль] + H2O
e.g. Mn2O7 + 2NaOH → NaMnO4 + H2O
4) Реакция с солью:
Менее летучие кислотные оксиды вытесняют в расплаве более летучие кислотные оксиды из соли
[кислотный оксид] + [соль] → [соответствующая к.о. соль] + [оксид, соответствующий кислотному остатку соли]
e.g. Na2CO3 + SiO2 → Na2SiO3 + CO2
XII билет: Кислоты. Классификация. Диссоциация в водных растворах сильных и несильных кислот. Получение кислот.
Кислоты – сложные вещества, состоящие из одного или больше атома H и кислотного остатка. Атом (атомы) водорода в кислоте способен замещаться (обмениваться) на атом (атомы) металла.
Классификация кислот.
I. По количеству атомов H:
· Одноосновные – HCl, HNO3 …
· Двухосновные – H2SO4, H2S …
· Трёхосновные – H3PO4 …
· …
II. По силе кислоты:
· Сильные: HCl, HBr, HI; Ɐ HyAOx | x – y ≥ 2
· Несильные: …
III. По устойчивости:
· Неустойчивые: H2CO3 → H2O + CO2, H2SiO3, HNO3 (концентрация ≥ 90%)
· Устойчивые
IV. По агрегатному состоянию:
· Газообразные: H2S; HCl, HBr, HI – без воды.
· Жидкие: H2SO4, HF …
· Твердые: H3PO4, H2SiO3
Более сильные кислоты диссоциируют в растворе лучше, чем более слабые.
e.g. H2SO4 → 2H+ + SO42−
H3PO4 → H+ + H2PO4− (как правило, дальше этого не заходит – ортофосфорная кислота слабая и плохо диссоциирует).
Получение кислот:
1) Реакция кислотного оксида с H2O:
[кислотный оксид*] + H2O → [соответствующая к.о. кислота]
e.g. SO3 + H2O → H2SO4
* – кроме SiO2
2) Реакция обмена между солью и другой кислотой:
[соль] + [кислота] → [соответствующая кислоте соль] + [соответствующая соли кислота]
Реакция обмена проходит, если выделяется газ/вода/осадок, если газ – один из реагентов может быть нерастворимым.
e.g. K2SiO3 + H2SO4 → K2SO4 + H2SiO3↓
XIII билет: Химические свойства кислот. Классификация составленных уравнений реакции. Цвета индикаторов в водных растворах кислот.
Химические свойства кислот:
I. С простыми веществами.
1) Металлами*:
e.g. H2SO4 + 2K → K2SO4 + H2↑ – реакция замещения
* – только с металлами до Pb в РСЭП
II. С оксидами.
1) Основными:
e.g. H2SO4 + Rb2O → Rb2SO4 + H2O
2) Амфотерными:
e.g. H2S + PbO → PbS + H2O
III. Со сложными веществами.
1) Щелочами:
e.g. NaOH + HClO4 → NaClO4 + H2O – реакция нейтрализации
2) Нерастворимыми основаниями:
e.g. Cu(OH)2 +2HCl → CuCl2 + 2H2O – реакция нейтрализации
3) Амфотерными гидроксидами:
e.g. Al(OH)3 + H3PO4 → AlPO4 + 3H2O – реакция нейтрализации
4) Солями (при выполнении условий протекания):
e.g. 3FeS + 2H3PO4 → Fe3(PO4)2 + 2H2S↑ – реакция обмена
Цвета индикаторов(все):
| Кислотная (H+) | Нейтральная | Щелочная () | |
| Лакмус | Розовый | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
XIV билет: Классификация неорганических веществ. Определение классов веществ. Генетические связи между разными классами веществ.
Классификация неорганических веществ и определение класса неорганического вещества по формуле:
I. Простые вещества – если в формуле только один элемент:
1. Металлы – если этот элемент металл.
2. Неметаллы – если этот элемент неметалл.
II. Сложные вещества – если в формуле два и более элемента:
1. Оксиды – если формула вида AxOy−2:
1) Основные – если A в формуле это металл со СТОК ≤ 2 (кроме Pb, Zn, Be, Sn).
2) Амфотерные – если A в формуле это металл со 2 ≤ СТОК ≤ 4 (+ вышеупомянутые металлы-исключения).
3) Кислотные – если A в формуле это металл со СТОК ≥ 4 или неметалл (кроме NO, N2O, CO, SiO).
4) Несолеобразующие – NO, N2O, CO, SiO.
2. Основания – если формула вида [Me≤2]x(OH)−y, кроме гидроксидов металлов-исключений для основных оксидов.
3. Амфотерные гидроксиды – если формула вида [Me2≤a≤4]x(OH)−y, + гидроксиды металлов-исключений для основных оксидов.
4. Кислоты – если формула вида Hx[X]y, где [X] – кислотный остатокРРРРРРрршщшощоащзытмзывлтмдавылтмв.
5. Соли - если формула вида [Me]x[X]y, где [X] – кислотный остатокРРРРРРрршщшощоащзытмзывлтмдавылтмв.
Генетические связи между классами веществ:
 Ca → S → Al
Ca → S → Al
↓ ↓ ↓
 CaO → SO3 → Al2O3
CaO → SO3 → Al2O3
↓ ↓ ↓
 Ca(OH)2 → H2SO4 → AL(OH)3
Ca(OH)2 → H2SO4 → AL(OH)3
↓ ↓ ↓
CaSO3 → Ag2SO4 → AlCl3
XV билет : Вода. Строение воды. Гибридизация атома кислорода в молекуле воды. Получение воды и ее химические свойства.
H2O – КПС, диполь
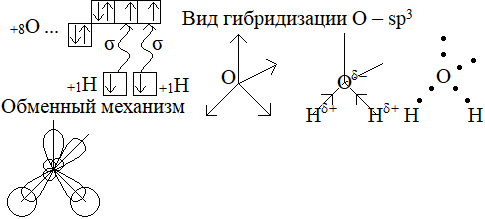
H2Oδ− … H2Oδ+ – молекулярная кристаллическая решетка.
Межмолекулярная связь, водородная связь.
Химические свойства воды:
I. Реагирует с простыми веществами:
1) Металлами: [акт.Me/Al] + H2O → [Me]OH + H2
2) Неметаллами: C + H2O ⸺(↑to)> CO + H2
II. Реагирует с оксидами:
1) Основные.
[Me]O + H2O → [Me]OH, в данном случае [Me] – активный металл из I A или II A подгруппы ниже Mg
e.g. BaO + H2O → Ba(OH)2
Исключение:
MgO + H2O ⸻(нагревание)> Mg(OH)2
2) Кислотные.
[кислотный оксид*] + H2O → [соответствующая к.о. кислота]
e.g. SO3 + H2O → H2SO4
* – кроме SiO2
III. Сложные вещества.
Кислоты, щелочи, растворимые соли – диссоциация на ионы.
Получение H2O:
1) Сгорание H2 в O2
2) Разложение гидроксидов и кислот
3) [кислотный оксид] + [щелочь] → [соответствующая к.о. соль] + H2O
4) [амфотерный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
5) [амфотерный оксид] + [щелочь] ⸻(расплав)> [соответствующая амф.о. соль] + H2O
6) [основный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
7) [щелочь/нерастворимое основание/амфотерный гидроксид] + [кислота] → [соответствующая кислоте соль] + H2O
XVI билет: Растворы. Виды растворов. Массовая доля веществ, молярная концентрация, плотность растворов. Диссоциация в водных растворах кислот, щелочей, солей.
Растворы – гомогенные физико-химические системы, состоящие из молекул растворителя и частиц растворенного вещества.
Если есть вода – она растворитель.
Если нет воды, то растворитель – вещество в том же агрегатном состоянии, что и вся смесь.
Если два или больше веществ в растворе в том же агрегатном состоянии, что и смесь, растворитель – вещество, массовая доля которого максимальна среди них.
Виды:
I. По агрегатному состоянию:
1) Твердые
2) Жидкие
3) Газообразные
II. По размерам частиц растворенного вещества:
1) Истинные (маленькие)
2) Коллоидные (большие)
III. По массовой доле растворенного вещества:
1) Разбавленные (маленькая)
2) Концентрированные (большая, близкая к максимальной)
3) Насыщенные (максимальная)
4) Пересыщенные (выше максимальной, нестабильны)
Числовые характеристики:
1) ω = 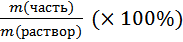 – массовая доля.
– массовая доля.
2) ρ = 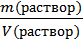 – плотность раствора.
– плотность раствора.
3) CM = 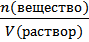 – молярная концентрация.
– молярная концентрация.
Диссоциация в водных растворах:
1) Кислот: более сильные кислоты диссоциируют до конца, более слабые и многоосновные диссоциируют слабее.
2) Щелочи: полностью диссоциируют.
3) Соли: те, что растворимы – полностью диссоциируют.
XVII билет: Щелочи. Получение, свойства.
Щелочи – электролиты, при диссоциации которых образуется катионы металла и гидроксид-анионы.
Получение щелочей:
1) [актMe] + H2O → [соответствующая щелочь] + H2
2) [оксид актMe] + H2O → [соответствующая щелочь]
3)* Электролиз водного раствора солей активных металлов.
Химические свойства щелочей:
I. Реагируют с простыми веществами:
1) Металлами.
[щелочь] + [Me*] ⸺(раствор)> [соответствующая металлу комплексная соль]
[щелочь] + [Me*] ⸺(расплав)> [соответствующая металлу соль] + H2
* – только металлы, не имеющие основных оксидов.
II. Реагируют с оксидами:
1) Амфотерными.
[щелочь] + [амфотерный оксид] → [соответствующая амф.о. соль] + H2O
2) Кислотными.
[щелочь] + [кислотный оксид] → [соответствующая к.о. соль] + H2O
III. Реагируют со сложными веществами:
1) Амфотерными гидроксидами.
[щелочь] + [амфотерный гидроксид] → [соответствующая амф.г/о комплексная соль] + H2O
2) Кислотами.
[щелочь] + [кислота] → [соответствующая кислоте соль] + H2O
3) Солями (только при соблюдении условий обмена.).
[щелочь] + [соль] → [соответствующая соль с металлом из щелочи] + [гидроксид с металлом из соли]
XVIII билет: Нерастворимые основания и амфотерные гидроксиды. Получение, свойства.
Нерастворимые основания – нерастворимые гидроксиды, кроме гидроксильной группы состоящие из металла со СТОК ≤ 2 (исключения – Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2, являющиеся амфотерными гидроксидами).
Амфотерные гидроксиды – нерастворимые гидроксиды, кроме гидроксильной группы состоящие из металла со 2 ≤ СТОК ≤ 4 (исключения – Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2, являющиеся амфотерными гидроксидами).
Получение:
0) (только для Al(OH)3) Реакция чистого Al с водой.
1) Реакция обмена щелочи с солью.
2) Реакция недостатка комплексной соли и кислоты.
3) Реакция воды, соли с соответствующим гидроксиду кислотным остатком и недостатком кислоты.
Химические свойства:
1) [нерастворимое основание/амфотерный гидроксид] + [кислота] → [соответствующая кислоте соль] + H2O
2) [амфотерный гидроксид] + [щелочь] + H2O → [соответствующая амф.г/о комплексная соль]
XIX билет: Соли. Классификация. Химические свойства.
Соли – сложные вещества, состоящие из атомов металла и кислотного остатка.
Классификация солей:
1) Основные соли – имеют в формуле OH.
2) Средние соли – имеют в формуле только один кислотный остаток, без H и OH.
3) Кислые соли – имеют в кислотном остатке H.
4) Смешанные соли – имеют в формуле два и более кислотных остатков.
5) Комплексные соли – соли , в состав которых входят комплексный катион и анион, либо катион и комплексный анион.
6) Двойные соли – в формуле два или более катионов металла.
Химические свойства солей:
I. Реагируют с простыми веществами:
1) Металлами.
[Me*] + [соль] → [соль] + [Ме]
* – только металл, который в РСЭП левее того, что в соли, и неактивный.
II. Реагируют с оксидами:
1) Амфотерными.
[амфотерный оксид*] + [соль] → [соответствующая амф.о. соль] + [оксид, соответствующий кислотному остатку соли]
* – Менее летучие амфотерные оксиды вытесняют в расплаве более летучие амфотерные/кислотные оксиды из соли
e.g. CaCO3 + Al2O3 → Ca(AlO2)2 + CO2
2) Кислотными.
[кислотный оксид*] + [соль] → [соответствующая к.о. соль] + [оксид, соответствующий кислотному остатку соли]
* – Менее летучие кислотные оксиды вытесняют в расплаве более летучие кислотные оксиды из соли.
e.g. Na2CO3 + SiO2 → Na2SiO3 + CO2
III.Реагируют со сложными веществами:
1) Щелочами.
[щелочь] + [соль] → [соответствующая соль с металлом из щелочи] + [гидроксид с металлом из соли]
2) Кислотами.
[соль] + [кислота] → [соответствующая соль с металлом из щелочи] + [гидроксид с металлом из соли]
e.g. 3FeS + 2H3PO4 → Fe3(PO4)2 + 2H2S↑
3) Солями.
[соль] + [соль] → [соль с металлом из одной соли, а кислотным остатком из другой] + [соль с металлом из одной соли, а кислотным остатком из другой]
XX билет: Получение солей.
I. Из металлов:
1) [Me] + [неMe] → [соответствующая соль]
2) [Me*] + [кислота] → [соль] + H2
* – только металл до Pb в РСЭП
3) [Me*] + [щелочь] ⸺(раствор)> [соответствующая металлу комплексная соль]
[Me*] + [щелочь] ⸺(расплав)> [соответствующая металлу соль] + H2
* – только металлы, не имеющие основных оксидов.
4) [Me*] + [соль] → [соль] + [Ме]
* – только металл, который в РСЭП левее того, что в соли, и неактивный.
II. Из оксидов:
1) [амфотерный оксид] + [основный оксид*] → [соответствующая амф.о. соль]
e.g. ZnO + K2O → K2ZnO2
* – оксид только активного металла.
2) [основный оксид] + [кислотный оксид] → [соответствующая к.о. соль]
e.g. K2O + SO3 → K2SO4
3) [основный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
e.g. CaO + 2HCl → CaCl2 + H2O
4) [амфотерный оксид] + [кислотный оксид] → [соответствующая к.о. соль]
e.g. Al2O3 + 3SO3 → Al2(SO4)3
4) [амфотерный оксид] + [щелочь] ⸻(расплав)> [соответствующая амф.о. соль] + H2O
e.g. BeO + 2KOH → K2BeO2 + H2
[амфотерный оксид] + [щелочь] + H2O ⸻(раствор)> [соответствующая амф.о. комплексная соль]
e.g. 2NaOH + ZnO + H2O → Na2[Zn(OH)4]
5) [амфотерный оксид] + [кислота] → [соответствующая кислоте соль] + H2O
e.g. PbO + 2HCN → Pb(CN)2 + H2O
6) [амфотерный оксид*] + [соль] → [соответствующая амф.о. соль] + [оксид, соответствующий кислотному остатку соли]
* – Менее летучие амфотерные оксиды вытесняют в расплаве более летучие амфотерные/кислотные оксиды из соли
e.g. CaCO3 + Al2O3 → Ca(AlO2)2 + CO2
7) [кислотный оксид] + [щелочь] → [соответствующая к.о. соль] + H2O
e.g. Mn2O7 + 2NaOH → NaMnO4 + H2O
8) [кислотный оксид*] + [соль] → [соответствующая к.о. соль] + [оксид, соответствующий кислотному остатку соли]
* – Менее летучие кислотные оксиды вытесняют в расплаве более летучие кислотные оксиды из соли.
e.g. Na2CO3 + SiO2 → Na2SiO3 + CO2
III. Из кислот:
1) [кислота] + [щелочь] → [соответствующая кислоте соль] + H2O
2) [кислота] + [нерастворимое основание] → [соответствующая кислоте соль] + H2O
3) [кислота] + [амфотерный гидроксид] → [соответствующая кислоте соль] + H2O
4) [соль] + [кислота] → [соль с металлом из соли, а кислотным остатком из кислоты] + [кислота с кислотным остатком из соли]
IV. Из щелочей:
1) [щелочь] + [амфотерный гидроксид] → [соответствующая амф.г/о комплексная соль] + H2O
2) [щелочь] + [соль] → [соответствующая соль с металлом из щелочи] + [гидроксид с металлом из соли]
V. Из солей:
1) [соль] + [соль] → [соль с металлом из одной соли, а кислотным остатком из другой] + [соль с металлом из одной соли, а кислотным остатком из другой]
Приложение 01 к билету I. Квантовая теория.
В рамках квантовой теории строения атома существуют три квантовых числа:
· Главное квантовое число n {1, 2, 3 …}
· Орбитальное квантовое число l {0, 1 … n-1}
· Магнитное квантовое число m {-l … +l}
Примеры:
| n | l | m | Обозначение орбитали |
| 1 | 0 | 0 | 1s |
| 2 | 0 | 0 | 2s |
| 1 | -1 | 2py | |
| 0 | 2pz | ||
| +1 | 2px | ||
| 3 | 0 | 0 | 3s |
| 1 | -1 | 3py | |
| 0 | 3pz | ||
| +1 | 3px | ||
| 2 | -2 | 3d | |
| -1 | 3d | ||
| 0 | 3d | ||
| +1 | 3d | ||
| +2 | 3d |
Обобщение:
ГКЧ n отвечает за расположение электрона на определённом эл. слое – совокупности орбиталей с одинаковым n .
ОКЧ l отвечает за расположение за форму эл. орбитали. Эл. оболочкой называют совокупность орбиталей с одинаковыми n и l.
МКЧ m отвечает за расположение эл. орбитали определенной формы в пространстве.
На одной орбитали могут располагаться два электрона. Для этого вводится четвёртое квантовое число – спин электрона, равный ±½.
Теория расположения эл. орбиталей по энергии.
Эл. оболочка располагается тем ниже по энергии, чем меньше сумма её квантовых чисел n + l. Если найдутся две орбитали с такой одинаковой суммой, но разными главными квантовыми числами n, то по энергии будет ниже та орбиталь, у которой число n меньше.
Например: 3d – орбиталь {n=3, l=2} по энергии выше, чем 4s {n=4, l=0}, но ниже, чем 4p {n=4, l=1}.
Электрон всегда занимает наиболее выгодную по энергии орбиталь, поэтому с ростом заряда ядра в периодической системе заполнение эл. облака идёт в определенном порядке (см. билет I).
Билеты I – XX подготовлены Александром Бигуловым, исправление фактических ошибок и Приложение 01 – Георгием Стеценко.








