Тема I . Получение серы и серной кислоты
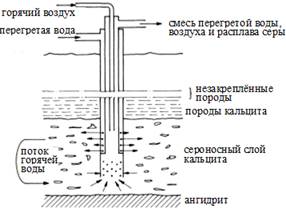
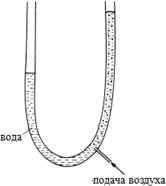
Рисунок S1. Фраш-процесс извлечения элементной серы
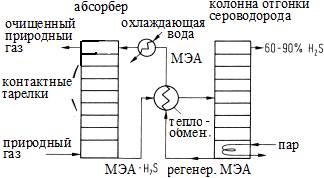
Рисунок S2. Установка обессеривания природного газа
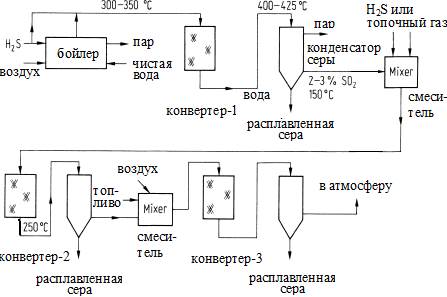
Рисунок S3. Схема 3-ступенчатого Клаус-процесса
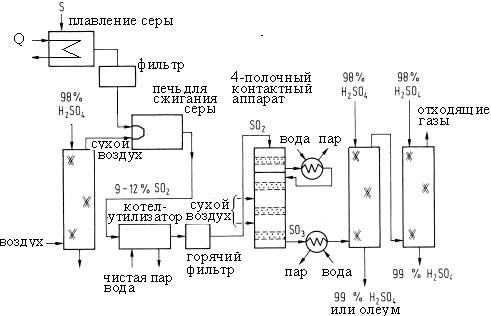
Рисунок S4. Контактный способ получения серной кислоты и олеума из серы
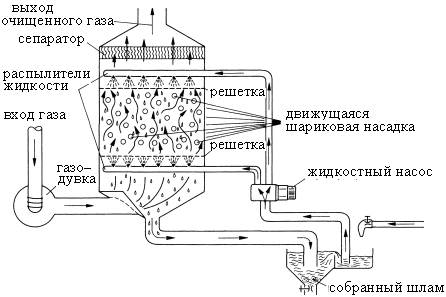
Рисунок S5. Скруббер с кипящим слоем для снижения выбросов диоксида серы и тумана серной кислоты
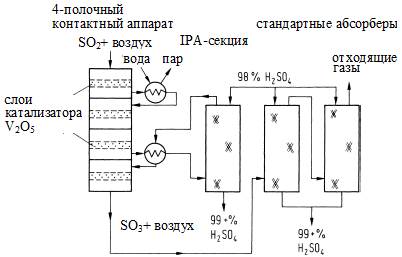
Рисунок S6. Схема производства серной кислоты, включающая IPA-секцию
для более полной конверсии и снижения выбросов SO2
Таблица S3. Промышленные хемосорбционные методы
очистки газов от диоксида серы
| № | Название метода | Абсорбент/ адсорбент | Уравнения реакций: А – абсорбция/адсорбция, Р – регенерация | Особенности процесса |
| Абсорбционные методы | ||||
| 1 | Абсорбция водой | Вода | А-Р: SO2 + H2O ↔ H2SO3 | Низкая эффективность, высокие энергозатраты |
| 2 | Известковые и известняковые | Суспензии извести, известняка (мела, доломита) | А: Ca(OH)2 + SO2 → CaSO3 + H2O, CaCO3 + SO2 → CaSO3 + CO2 CaSO3 + 0,5O2 → CaSO4 | Образование отходов - шламов сульфита или сульфата кальция (гипса) |
| 3 | Магнезитовый | Суспензия оксид-гидроксида магния | А: MgO + H2O → Mg(OH)2, MgSO3 + H2O + SO2 → Mg(HSO3)2, Mg(HSO3)2 + Mg(OH)2 → 2MgSO3 + 2H2O Р: MgSO3 → MgO + SO2 | Регенерация – обжиг MgSO3 при 900 °С. Концентрация SO2 в газе 7-15 %, с превращением в H2SO4 |
| 4 | Цинковый | Суспензия оксида цинка | А: SO2 + ZnO + 2,5H2O → ZnSO3·2,5H2O Р: ZnSO3·2,5H2O → SO2 + ZnO + 2,5H2O | Очистка газов при Т до 250 °С. Регенерация - сушка и обжиг ZnSO3 при 350 °С (неполная) |
| 5 | Абсорбция хемосорбентами на основе натрия | Раствор соды или гидроксида натрия | А: Na2CO3 + SO2 → Na2SO3 + CO2, Na2SO3 + SO2 + H2O → 2NaHSO3 Р: NaHSO3 + ZnO → ZnSO3 + NaOH, ZnSO3 → ZnO + SO2 | Очистка газов любой концентрации, SO2 пере-рабатывают в H2SO4 или S. |
| 6 | Сульфит-бисульфитный | Раствор сульфита натрия | А: Na2SO3 + SO2 + H2O → 2NaHSO3 Р: 2NaHSO3 → Na2SO3 + SO2 + H2O(при нагревании) | Процесс « Wollman - Lord »: рекуперация SO2 в виде H2SO4 или S по методу Клауса с выходом 90 % |
| 7 | Двойной щелочной | Растворы солей натрия, калия или аммония | А: Na2CO3 + SO2 → Na2SO3 + CO2 Р: CaO + H2O ↔ Ca(OH)2, Na2SO3 + Ca(OH)2 ↔ 2NaOH + CaSO3, Na2SO3 + Ca(OH)2 + 0,5O2 ↔ 2NaOH + CaSO4 | Продукты рекуперации – гипс, сульфит кальция, высокая эффективность, пониженные затраты |
| 8 | Аммиачные: | Раствор аммиака или сульфита аммония | А: NH4OH + H2SO3 ↔ (NH4)2SO3 + 2H2O, (NH4)2SO3 + H2SO3 ↔ 2NH4HSO3, 2(NH4)2SO3 + O2 ↔ 2(NH4)2SO4 | Высоко-эффективные методы с дешёвыми абсорбентами. В нециклическом варианте продукт – твердый NH4HSO3 |
| циклический | То же | А: То же Р: 2NH4HSO3 ↔ (NH4)2SO3 + H2O + SO2 | Регенерация: t=90°C, вакуум Очистка газов с концентрацией SO2 > 0,3 об. % | |
| бисульфитный | То же | А: То же Р: (NH4)2SO4 → NH3 + NH4HSO4 (300 °С) | Очистка газов любого состава | |
| кислотный | То же | А: То же Р: 2NН4НSО3 + Н2SO4 → (NН4)2SO4 + 2SO2 + 2H2O, (NH4)2SО3 + Н2SО4 → (NН4)2SO4 + SO2 + Н2O | Обработка кислотами Н2SO4, HNO3 или Н3РО4 с образованием 15-30 %-го SO2 и (NH4)2SO4, NH4 NO3, (NH4)3PO4 | |
| 9 | Абсорбция расплавленными солями | Расплав карбонатов щелочных металлов | А: Me=Li,Na,K Me2CO3расплав + SO2газ → Me2SO3твердый + CO2газ, Me2CO3расплав + SO2газ + 0,5O2 → Me2SO4твердый + CO2газ Р: 4Me2SO3 → 3Me2SO4 + Me2S, Me2SO4 + 4H2 → Me2S + 4H2O, Me2SO4 + 4CO → Me2S + 4CO2; Me2S + CO2 + H2O → Me2CO3 + H2S | Степень поглощения SO2 99 % при содержании от 0,3 до 3 об. %. H2S превращают в серу методом Клауса. Восстановление генераторным газом при 600 °С, регенерация смесью CO2 + H2O при 425°С. |
| 10 | Абсорбция ароматическими аминами | Раствор ксилидина или диметил-анилина | А: 2C6H3(CH3)2NH2 + SO2 ↔ 2C6H3(CH3)2NH2·SO2 Р: обратная реакция | Начальная концентрация SO2 – 0,5-8 об. %, конечная – 0,05-0,1 об. %. |
| Адсорбционные методы | ||||
| 11 | Хемосорбция известняком, известью, доломитом | Известняк, известь, доломит (порошок) | А: CaCO3 + SO2 → CaSO3 + CO2, CaCO3 + SO2 + 0,5O2 → CaSO4 + CO2 Р: отсутствует | Переработка SO2 в cульфит кальция или безводный гипс |
| 12 | Окисно-марганцевый метод | Оксид марганца (порошок) | А: MnOX·nH2O + SO2 + (1-0,5X)O2 → MnSO4 + nH2O Р: MnSO4 + 2NH3 + (n+1)H2O + (0,5X-0,5)O2 → MnOX·nH2O + (NH4)2SO4 | Процесс «Мицубиси». Степень очистки от SO2 90 % при содержании 0,15 об. %. |
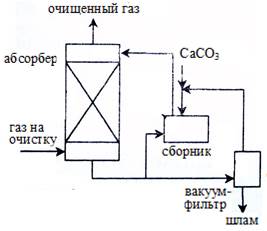
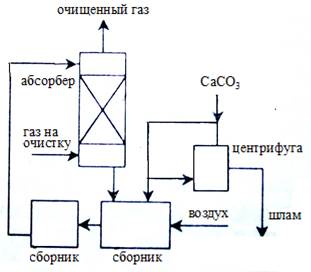
А Б
Рисунок S7. А. Установка абсорбции диоксида серы суспензией известняка
Б. То же, с окислением сульфита кальция








