Поясните. Как Вы понимаете эту закономерность.
Ответ: Во всех карбокатионах имеется трехвалентный атом углерода, несущий положительный заряд (+). Углерод является неметаллом, а потому ему несвойственно отдавать валентные электроны и существовать в виде катионов (подобно Na+, K+).
Электронодонорные группы, связанные с электронодефицитным центром (С+), должны стабилизировать карбокатион. Поскольку алкильные группы являются электронодонорными (проявляют +I эффект), то чем большее их количество связано с электронодефицитным центром (С+), тем стабильнее должен быть катион.
Третичные карбокатионы являются наиболее стабильными, поскольку с электронодефицитным центром (С+) связаны три алкильный группы. В метильном катионе (СН3+) с атомом углерода связаны лишь атомы водорода и ни одной донорной алкильной группы, в связи с чем этот катион является наименее стабильным из всех алкильных.
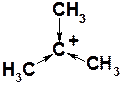
53. Приведите механизм следующего превращения:
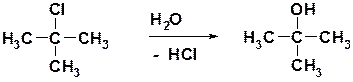
Ответ: Реакция представляет собой процесс нуклеофильного замещения. Поскольку исходный галогенид – третичный, то реакция протекает по механизму SN1, имеющему следующий вид:
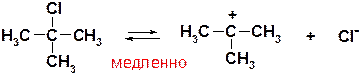
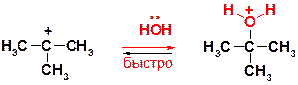
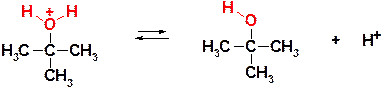
Пояснение: Процесс начинается с диссоциации субстрата по связи С-Cl (гетеролитический разрыв связи), движущей силой процесса является образование сравнительно стабильного третичного карбокатиона (именно поэтому для третичных субстратов характерен такой –диссоциативный- механизм).
Образующийся катион (трет-бутильный) является электрофильной частицей и взаимодействует с нуклеофильными молекулами воды. На этой (второй) стадии образуется новая связь С-О, а на трехвалентном кислороде возникает формальный целочисленный положительный заряд (+).
Процесс заканчивается отщеплением протона от образовавшегося катиона оксония и образованием молекулы спирта – конечного продукта реакции.
53. Изобразите (в виде набора крайних структур) резонансную стабилизацию аллильного катиона.
Ответ:

Такая форма записи означает, что аллильный катион представляет собой нечто среднее между вышеприведенными структурами. Исходя из вышеприведенных крайних структур становится понятным, что строение аллильного катиона может быть также отображено следующим образом: 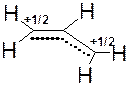
54. Какими электронными эффектами обладают алкильные группы? Являются ли эти группы электронодонорными или электроноакцепторными?
Ответ: Алкильные группы являются электронодонорными и проявляют положительный индуктивный (+I) эффект. Индуктивный эффект – это смещение электронов σ-связи от донорного заместителя к электроноакцепторному. Донорность алкильных групп обеспечивает сравнительно высокую стабильность третичных карбокатионов:

54. Гидроксильная группа (ОН), амино-группа ( NH2), метокси-группа (ОСН3), а также атомы галогенов обладают отрицательным индуктивным (- I) и положительным мезомерным (+М) эффектами. Как Вы это понимаете?
Ответ: Индуктивный эффект – это смещение электронов σ-связи от донорного заместителя к электроноакцепторному. Указанные группы присоединениы к остальной части органической молекулы через атом с высокой электроотрицательностью, а поэтому оттягивают к себе электроны σ-связи :
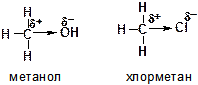
Это приводит к возникновению частичных зарядов на атомах (δ+ и δ-).
В то же самое время, эти заместители при определенных условиях могут проявлять и электронодонорные свойства. Это связано с наличием на электроотрицательных атомах кислорода, азота и галогенов одной или нескольких неподеленных электронных пар. Эта электронная пара находится на р-орбитали и эта р-орбиталь таким образом является полностью заполненной. Если соседний атом содержит вакантную р-орбиталь или наполовину заполненную р-орбиталь, то атомы кислорода, азота или галогенов выступают в роли доноров электронной плотности, поскольку их р-обиталь полностью занята и электроны с нее могут переходить на пустые р-орбитали соседних атомов.
Рассмотрим в качестве примера фторметильный катион (СН2F+). Центральный атом углерода (С+) находится в sp2-гибридном состоянии и обладает вакантной р-орбиталью. Рядом находится атом фтора с полностью заполненной р-орбиталью. Говорят, что атом фтора проявляет –I и +М эффекты.

Обозначают наличие мезомерного эффекта по-разному. К примеру, изогнутой стрелкой:
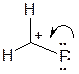
Альтернативно в рамках теории резонанса используют крайние структуры (граничные структуры). Так, атом углерода (С+) и атом фтора могут образовать дополнительную связь по донорно-акцепторному механизму, ведь у углерода есть вакантная орбиталь, а у фтора – неподеленная электронная пара. Тогда строение фторэтильного катиона изображают набором структур, полагая, что реальное строение есть нечто среднее между этими структурами:
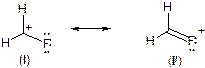
55. Какими электронными эффектами обладает группа ОН (гидроксильная, или спиртовая)?
Ответ: Гидроксильная группа проявляет –I и +M эффекты (отрицательный индуктивный и положительный мезомерный). Первый из эффектов связан с высокой электроотрицательностью атома кислорода, благодаря чему электроны σ-связи («сигма»-связи) смещены к атому кислорода. Донорный мезомерный эффект (+М) связан с наличием неподеленной электронной пары на атоме кислорода.
56. Какими электронными эффектами обладают атомы галогенов ( F, Cl, Br, I)?
Ответ: Атомы галогенов проявляют –I и +M эффекты (отрицательный индуктивный и положительный мезомерный). Первый из эффектов связан с высокой электроотрицательностью атомов галогенов (выше, чем у водорода), благодаря чему электроны σ-связи («сигма»-связи) смещены к атому галогена. Донорный мезомерный эффект (+М) связан с наличием неподеленной электронной пары на атоме галогена.
57. Как Вы понимаете понятие частичный заряд (« d+» и « d-»), в чем его отличие от целочисленного заряда?
Ответ: Необходимо ясно уяснить для себя отличие целочисленного формального заряда, приписываемого атому, от частичного заряда δ (читается «дельта»). Поясним это подробнее.
Атом водорода можно обозначить как Н или как Н., указывая на наличие у него одного электрона. Атом водорода электронейтрален. Два атома водорода образуют молекулу водорода, в которой два электрона связи Н-Н находятся строго посередине между атомами водорода (ковалентная неполярная связь). Считается, что в молекуле водорода Н2 на атомах нет ни частичного положительного, ни частичного отрицательного заряда.
С другой стороны, рассмотрим молекулу фтороводорода, образованную из одновалентных атомов водорода и фтора. Два электрона связи Н-F располагаются ближе к более электроотрицательному атому фтора. На атоме водорода возник частичный положительный заряд «d+», а на атоме фтора – частичный отрицательный «d-».

Но это именно частичные заряды «d+» и «d-», поскольку связь H-F является ковалентной полярной, а не ионной и электронная пара частично, а не полностью (как в случае ионной связи) смещена к атому фтора. Заряды «d+» и «d-» в молекуле HF по абсолютному значению (то есть по модулю) больше нуля, но меньше единицы, поскольку атом водорода лишь частично отдал свой валентный электрон атому фтора. Точные значения величин «d+» и «d-» ( к примеру, +0.30 и -0.30 или что-то около) могут быть определены физическими методами, однако для объяснения особенностей протекающих химических реакций зачастую достаточно лишь знать, что на атоме водорода имеется какой-то частичный положительный заряд. Точное его значение обычно не так важно.
Если связь Н-F разорвать гетеролитически, чтобы два электрона связи перешли к атому фотора, то получаться две частицы, обладающие уже не частичными зарядами «d+» и «d-», а полными зарядами +1 и -1, поскольку тот электрон, который раньше принадлежал атому водорода сейчас ПОЛНОСТЬЮ перешел к атому фтора:
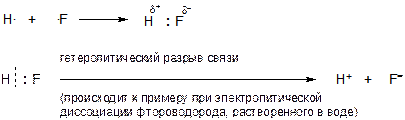
Если от атома водорода оторвать электрон, то получится частица, обозначаемая как «Н+» и называемая «протон». В данном случае знак «+» - это уже целочисленный, а не частичный заряд.
58. Опишите при помощи символов δ+ и δ- распределение заряда в следующих частицах:
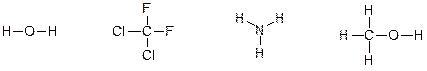
Ответ: Краткий ответ: Фтор, кислород, азот и хлор – типичные неметаллы, характеризующиеся высокой электроотрицательностью и стремлением притягивать электроны от менее электроотрицательных атомов.

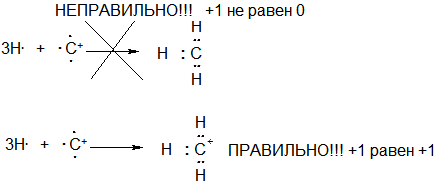
59. Известно, что на трехвалентном кислороде, четырехвалентном азоте и трехвалентном углероде с вакантной орбиталью всегда имеется формальный целочисленный положительный заряд «+1». Как Вы это понимает?
Ответ: Формулу метильного катиона можно записать не только как +СН3, но и как СН3+ (практически равнозначные записи). В последнем случае знак «+» указывает на заряд частицы в целом. При записи +СН3 знак «+» тоже указывает на заряд частицы в целом, но он также указывает на валентное состояние углерода (вокруг углерода не восемь как в молекуле метана или метильном анионе, не семь, как в метильном радикале, а шесть электронов, да и сам метильный катион может быть образован из трех атомов водорода и катиона углерода С+). Этот знак «+» называется в данном случае формальным зарядом, он описывает электронное состояние атома углерода.
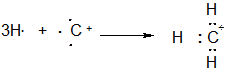
Итак, метильный катион имеет заряд +1, формально мы приписываем этот заряд атому углероду, поскольку этот заряд описывает его валентное состояние (напомним еще раз, что сам метильный катион может быть образован из трех атомов водорода и катиона углерода С+). Однако не следует думать, что весь положительный заряд в метильном катионе СН3+ сосредоточен только на атоме углерода. НИЧЕГО ПОДОБНОГО.
Связи углерода с водородом (С-Н) образованы за счет двух электронов (по одному неспаренному электрону от каждого атома, как и любая ковалентная связь, образованная по обменному механизму). Электроны этих связей С-Н могут смещаться к атому углерода, то есть располагаться не строго посередине между атомами углерода и водорода, а ближе к углеродному атому. При этом на атомах водорода возникает ЧАСТИЧНЫЙ ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД (не целый, не формальный заряд «+1», как ранее, а именно частичный), обозначаемый символом «d+» (читается : «дельта плюс»). Строение метильного катиона можно изобразить при этом одним из нижеприведенных способов. Все они практически равнозначны, однако на практике чаще используется последнее обозначение ввиду его простоты, при этом то, что положительный заряд не сконцентрирован только на атоме углерода, а размыт, ДЕЛОКАЛИЗОВАН по всему катиону ПОДРАЗУМЕВАЕТСЯ.

Суммарный положительный заряд частицы по-прежнему равен +1, однако при такой записи (первые две формулы) указывается, что этот заряд распределен между атомом углерода и тремя атомами водорода. Конкретные значения d+ и d/+ (к примеру, +0.1 и +0.7) могут быть определены физическими методами, однако для органической химии важно понимание наличия этих частичных зарядов, конкретные величины зарядов обычно не так существенны.
Умение приписывать атому в соединении или ионе целочисленный формальный заряд весьма важно, поскольку метильный катион можно обозначить лишь как +СН3 (или СН3+), запись СН3 не может использоваться для обозначения метильного катиона, поскольку СН3 – это электронейтральная частица, образованная из электронейтрального атома углерода и трех электронейтральных атомов водорода, то есть СН3 – это метильный радикал.
ЗАПОМНИТЕ!!!
Неправильное указание формального заряда считается грубой ошибкой. Обычно при этом, в написанном уравнении не выполняется закон сохранения заряда, что тоже является грубейшей ошибкой.
Существует несколько способов определения формального заряда. Так, выше было пояснено, что метильный анион Н3С- получается из трех атомов водорода и аниона С- , и именно поэтому атом углерода в метильном анионе имеет формальный заряд –1, что отражает электронное состояние атома углерода (количество электронов и атомов вокруг него).
Приведем еще один способ определения формального заряда атома. Рассмотрим, к примеру, процесс гетеролитического разрыва свзия С-Н в метане (см. схему) и поясним, что при этом действительно образуется метильный анион и протон.
В процессе разрыва связи получается «атом водорода без электронов», то есть Н+. Уже из этого следует, что вторая из частиц, получающаяся в этом процессе имеет заряд ‑1, поскольку должен выполняться закон сохранения заряда (ВСЕГДА!!!): в левой части стоит электронейтральная молекула метана, следовательно и в правой части реакции суммарный заряд всех частиц должен быть равен нулю (‑1 +1 = 0). То есть и так ясно, что получается отрицательно заряженная частица СН3-. Однако какому конкретно атому (водорода или углерода) следует приписать формальный заряд –1?
Рассмотрим электронное состояние атома углерода (см. схему ниже). Он окружен четырьмя парами электронов: одна из них является неподеленной электронной парой (и принадлежит только углероду), а три другие пары электронов являются связывающими, поскольку они связывают атом углерода с тремя атомами водорода. Два электрона связи С:Н принадлежат как атому углерода, так и атому водорода. Для определения формального заряда углерода поступим следующим образом. Будем считать, что один из электронов связывающей пары электронов С:Н принадлежит углероду, а второй – принадлежит водороду. Углерод в образующейся частице образует три связи С:Н, на которых находится шесть электронов, из этих шести электронов атому углероду принадлежит всего три. На атоме углерода есть еще неподеленная электронная пара, то есть два электрона, полностью принадлежащие углероду. Итого, углероду в полученной частице всего принадлежит 3+2=5 электронов. Напомню, что углерод стоит в четвертой группе, то есть обладает четырьмя валентными электронами. А в полученной частице углерод имеет пять, а не четыре, электрона, то есть один электрон – лишний, а поскольку электрон имеет заряд –1, то атому углерода в полученной частице следует приписать формальный заряд –1.
Аналогичным образом в данном процессе получается «атом водорода без электронов», тогда как у реального атома водорода один валентный электрон. Одного электрона не хватает, то есть получается частица Н+.
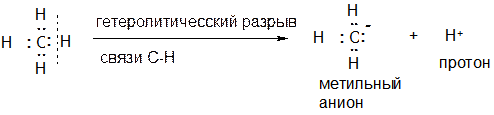
Аналогичным образом рассмотрим процесс гетеролитического разрыва связи С-Н, приведенный ниже. Углерод в полученной частице окружен шестью электронами, но самому углероду из них принадлежит лишь три. Электронейтральный атом углерода имеет четыре электрона, то есть в данном случае одного электрона не хватает и атому углерода в полученной частице следует приписать формальный заряд +1.
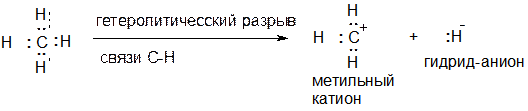
Рассмотрим еще несколько примеров. Вы, вероятно, знаете, что протон Н+ в воде гидратирован и существует в виде иона гидроксония Н3О+. Схема образования молекулы воды из атома кислорода и двух атомов водорода и последующего образования иона гидроксония из молекулы воды и протона изображена ниже.
Напомним, что протон образует ковалентную связь с атомом кислорода молекулы воды по так называемому донорно-акцепторному механизму, когда один атом (донор, он же нуклеофил) предоставляет неподеленную электронную пару, а второй (акцептор, он же электрофил) – пустую орбиталь. В данном случае кислород является донором электронной пары, а протон, обладающий пустой 1s орбиталью является акцептором этой электронной пары.
Понятно, что частица, образующаяся из протона и молекулы воды имеет заряд +1 (ЗАКОН СОХРАНЕНИЯ ЗАРЯДА ВЫПОЛНЯЕТСЯ ВСЕГДА!!!). Однако какому атому приписать формальный заряд +1? Посчитаем количество электронов, принадлежащих атому кислорода в ионе гидроксония. Их количество равно 2 (неподеленная электронная пара на кислороде) плюс 3 (три связи О:Н), то есть пять, а электронейтральный атом имеет шесть валентных электронов, а не пять, поскольку кислород стоит в шестой группе. Одного электрона не хватает. При отрыве одного электрона от атома кислорода он приобретает заряд +1. Итого : в ионе гидроксония заряд +1 формально принадлежит атому кислорода, это его формальный заряд, отражающий его валентное состояние.
Аналогичным образом можно прийти к выводу, что в молекуле воды ни атом кислорода, ни атом водорода не имеют формальных зарядов, поскольку атому кислорода в воде принадлежит 6 электронов, а атому водорода – один, что соответствует нейтральным атомам. Можно также проверить, что в ионе гидроксония Н3О+ атомы водорода не имеют формального заряда, поскольку каждому из атомов водорода принадлежит всего один электрон.
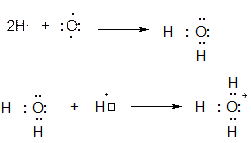
К аналогичным выводам можно прийти и другим путем (см. схему ниже). Атом кислорода стоит в шестой группе и имеет электронную конфигурацию …2s22p4, при этом количество неспаренных электронов равно двум. Именно поэтому атом кислорода двухвалентен и образует к примеру две ковалентные связи О:Н с атомами водорода за счет своих неспаренных электронов (см. предыдущую схему).
Мысленно оторвем от атома кислорода один электрон, что приведет к получению частицы О+, имеющий пять валентных электронов и электронную конфигурацию …2s22p3. В катионе О+ имеется три неспаренных электрона, то есть ион О+ трехвалентен и может образовать три ковалентные связи О:Н по обменному механизму, что приведет к образованию того же самого иона гидроксония Н3О+ с формальным зарядом атома кислорода +1.
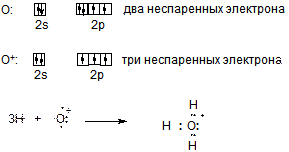
ЗАПОМНИТЬ!!!
ТРЕХВАЛЕНТНЫЙ КИСЛОРОД И ЧЕТЫРЕХВАЛЕНТНЫЙ АЗОТ ВСЕГДА ИМЕЮТ ФОРМАЛЬНЫЙ ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД!!! ДВУХВАЛЕНТНЫЙ КИСЛОРОД, ТРЕХВАЛЕНТНЫЙ АЗОТ, ЧЕТЫРЕХВАЛЕНТНЫЙ УГЛЕРОД И ОДНОВАЛЕНТНЫЙ ВОДОРОД, ОДНОВАЛЕНТНЫЕ ФТОР, ХЛОР И БРОМ НЕ ИМЕЮТ ФОРМАЛЬНОГО ЗАРЯДА, ПОСКОЛЬКУ НАХОДЯТСЯ В НАИБОЛЕЕ ХАРАКТЕРНЫХ ДЛЯ НИХ ВАЛЕНТНЫХ СОСТОЯНИЯХ.
Это объясняется тем, что атом кислорода обычно двухвалентен, а азота – трехвалентен, поскольку имеют два и три соответственно неспаренных электрона и используют их для образования ковалентных связей по обменному механизму, то есть по одному неспаренному электрону от каждого из атомов, образующих связь (соединения Н2О, NН3). Дополнительную связь эти атомы могут образовать лишь по донорно-акцепторному механизму, например при взаимодействии воды или аммиака с протоном, поскольку как атом кислорода в воде, так и атом азота в аммиаке имеют неподеленную электронную пару. При образовании ковалентной связи по донорно-акцепторному механизму, атом кислорода или азота отдает не один электрон (как при обменном механизме), а два, то есть отдает один лишний электрон, повышая свой заряд на единицу.
Обратите внимание на следующие примеры и запомните, что трехвалентный кислород и четырехвалентный азот характеризуются формальным зарядом +1.
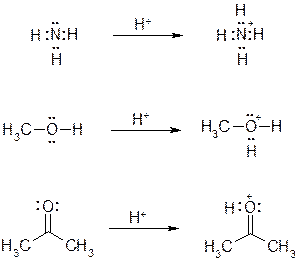
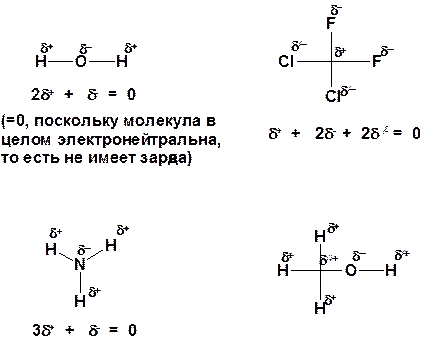
60. Укажите продукты присоединения протона к следующим соединениям, в продуктах протонирования правильно укажите формальные целочисленные заряды.
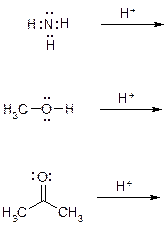
Ответ: Протонированию подвергаются атомы кислорода и азота, обладающие неподеленной электронной парой. При этом новая ковалентная связь образуется по донорно-акцепторному механизму. В продуктах протонирования на трехвалентном кислороде и четырехвалентном азоте обязательно указываем формальный заряд «+1».
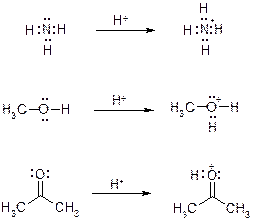
61. Молекулы этана (Н3С-СН3) и метанола (Н3С-ОН) имеют схожий размер и молекулярный вес, но очень сильно отличаются по температуре кипения (- 88 оС для этана и +65оС для метилового спирта). Как можно объяснить такое отличие в температурах кипения?
Ответ: Связь О-Н в молекулах спиртов является ковалентной полярной, причем электроны связи сдвинуты в сторону более электроотрицательного атома кислорода, а на атомах возникают частичные заряды (δ).
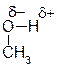
Благодаря этим зарядам молекулы метилового (и других спиртов) могут электростатически взаимодействовать друг с другом. Это диполь-дипольное взаимодействие обычно называют водородной связью. Образование водородных связей между молекулами возможно лишь для спиртов, но не для алканов (каковым является этан), поскольку связь С-Н малополярна (электроотрицательности углерода и водорода близки).

62. Метанол (Н3С-ОН) и этанол (С2Н5ОН) смешивается с водой в любых отношениях, тогда как жидкие углеводороды (алканы, алкены) ив воде почти нерастворимы. Как это можно объяснить?
Ответ: Вода и спирты являются ассоциированными жидкостями, то есть их молекулы образуют между собой так называемые водородные связи.


Смешивание (взаимная растворимость) этих веществ объясняется тем, что водородная связь так же эффективно может возникать между молекулами спирта и молекулами воды:

Молекулы углеводородов не способны к образованию водородных связей, плохо взаимодействуют с молекулами воды, а потому практически не растворяются в ней (к тому же, их растворение препятствовало бы образованию водородных связей между молекулами самой воды).








