30 Приведите структурные формулы следующих соединений: а) бензола б) толуола; в) фенола; г) бензальдегида; д) бензойной кислоты; е) 2,4,6‑тринитротолуола.
ОТВЕТ:
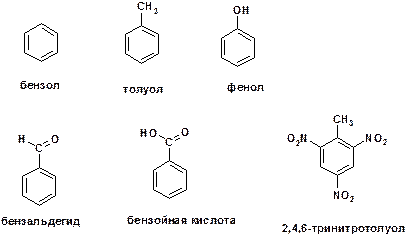
31. Какой тип реакций наиболее характерен для бензола и его производных?
Ответ: Для бензола и его производных характерны реакции замещения. При этом атом водорода бензольного кольца подвергается замещению на какую-либо группировку Х (в зависимости от действующего реагента). 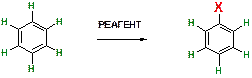
Все атомы водорода в бензольном кольце идентичны и вне зависимости от того, какой из них подвергнется замещению, образуется один и тот же продукт. Иными словами рядом изображено одно и то же соединение (просто одна молекула повернута относительно другой на некоторый угол). 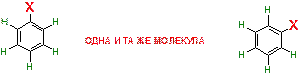
Обычно для краткости не изображают все атомы водорода в исходной молекуле, а также в молекуле продукта. Тогда схема процесса выглядит следующим образом: 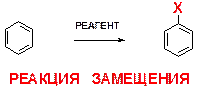 . При этом надо четко понимать, что это – та же самая реакция замещения.
. При этом надо четко понимать, что это – та же самая реакция замещения.
То, что ароматическим соединениям (к примеру, бензолу) характерны реакции замещения, а не присоединения (несмотря на наличие двойных связей), является достаточно необычным. Связано это с повышенной стабильностью этих соединений, обозначаемой обычно термином «ароматичность».
32. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
ОТВЕТЫ:
А) 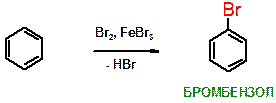
Пояснение: Реакция бромирования бензола. Бромид железа(III) служит катализатором. Альтернативно в качестве катализатора иногда используют опилки металлического железа, которые первоначально при взаимодействии с бромом (Br2) дает FeBr3, который является истинным катализатором.
Б) 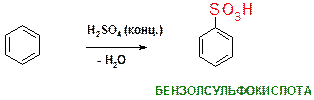
Пояснение: Реакция сульфирования бензола. Атом водорода подвергается замещению на сульфо-группу (SO3Н). Реакция в целом сопровождается отщеплением молекулы воды, что можно проиллюстрировать следующей схемой:
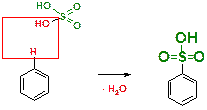
В) 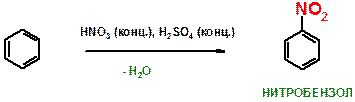
ПОЯСНЕНИЕ: Реакция нитрования бензола, протекающая при действии нитрующей смеси (смесь концентрированных азотной и серной кислот). Атом водорода подвергается замещению на нитро-группу (NO2). Реакция также сопровождается отщеплением воды, что может быть проиллюстрировано схемой: 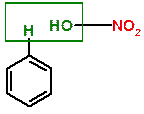 Серная кислота в этой реакции служит в качестве водоотнимающего средства.
Серная кислота в этой реакции служит в качестве водоотнимающего средства.
Г) 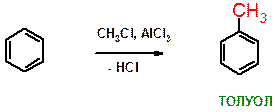
Пояснение: Реакция алкилирования бензола по Фриделю-Крафтсу. Хлорид алюминия служит катализатором реакции.
Д) 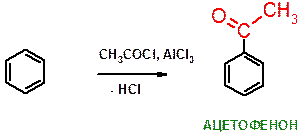
Пояснение: Реакция ацилирования бензола по Фриделю-Крафтсу. Хлорид алюминия служит катализатором реакции. В данном случае атом водорода заменяется на ацетильную группу (СОСН3) – остаток уксусной кислоты (acetic acid).
33. Что такое орто-, мета- и пара-положения?
ОТВЕТ: В случае монозамещенных производных бензола (где один из атомов водорода замещен на какой-либо заместитель), оставшиеся атомы водорода перестают быть идентичными. Обычно говорят про атомы водорода, находящиеся в орто-, мета- или пара-положениях. 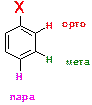
34. Какие заместители относятся к мета-ориентантам? Как вы понимаете понятие «мета-ориентанты»?
ОТВЕТ: Монозамещенные производные бензола вступают в те же самые реакции замещения, которые характерны для самого бензола. Поскольку атомы водорода в этих монозамещенных являются неэквивалентными, то в зависимости от того, какой из этих атомов подвергнется замещению получатся разные продукты. 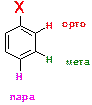
Это (какой водород подвергнется замещению) зависит в основном от заместителя Х, который уже присутствует в исходном соединении. Заместителя делят на орто/пара-ориентанты, и мета-ориентанты.
Мета-ориентанты направляют реакцию по пути замещения мета-атома водорода. К примеру: 
Приведенная реакция – реакция бромирования нитробензола, причем замещению подвергается именно атом водорода в мета-положении по отношению к нитро-группе. Говорят, что нитро-группа является мета-ориентантом. Другие заместители, являющиеся мета-ориентантами:
SO3H – cульфо-группа
CHO альдегидная (формильная) группа
COOH карбоксильная группа
COCH3 ацетильная группа
СЛЕДУЕТ ЗАМЕТИТЬ, ЧТО К МЕТА-ОРИЕНТАНТАМ ОТНОСЯТСЯ ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ. ТАК, ВСЕ ВЫШЕПРИВЕДЕННЫЕ мета-ориентанты обладают –I и –M-эффектами (отрицательным индуктивным и отрицательным мезомерным эффектами).
35. Какие заместители относятся к орто/пара-ориентантам? Как вы понимаете понятие «орто/пара -ориентанты»?
ОТВЕТ: Монозамещенные производные бензола вступают в те же самые реакции замещения, которые характерны для самого бензола. Поскольку атомы водорода в этих монозамещенных являются неэквивалентными, то в зависимости от того, какой из этих атомов подвергнется замещению получатся разные продукты. 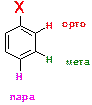
Это (какой водород подвергнется замещению) зависит в основном от заместителя Х, который уже присутствует в исходном соединении. Заместителя делят на орто/пара-ориентанты, и мета-ориентанты.
Орто/пара-ориентанты направляют реакцию по пути замещения в орто- или в пара-положение, так что обычно получается смесь двух продуктов. К примеру: 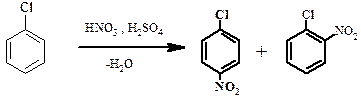
Приведенная реакция – реакция нитрования хлорбензола, причем замещению подвергается именно атомы водорода в орто- или пара-положении по отношению к атому хлора. Говорят, что хлор является орто/пара-ориентантом. Другие заместители, являющиеся орто/пара-ориентантами:
СН3, С2Н5 (алкильные группы)
F, Cl, Br, I – атомы галогенов
ОН – гидроксильная группа
ОСН3 – метокси-группа
NH2 – амино-группа
Следует особо подчеркнуть, что в большинстве своем это электронодонорные заместители, обладающие либо электронодонорным +I (положительным индуктивным), либо электронодонорным +М (положительным мезомерным) эффектом. К примеру, алкильные группы обладают +I, а все остальные приведенные орто/пара ориентанты +М эффектом, который связан с наличием неподеленной электронной пары на атоме, непосредственно связанном с бензольным кольцом (галоген, кислород, азот).
36. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
ОТВЕТЫ:
А) 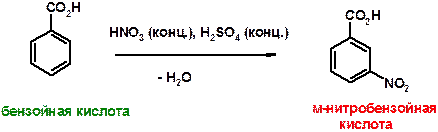
Б) 
В) 
Пояснение: реакция нитрования толуола. Метильная группа является орто/пара-ориентантом, поэтому в качестве продуктов образуются орто- и пара-нитротолуолы – продукты замещения атомов водорода в орто- или пара-положениях на группу NO2 (нитро-группа).
Г) 
Пояснение: Реакция сульфирования толуола. Атом водорода замещается на сульфо-группу (SO3H). Метильная группа (присутствующая в молекуле толуола) является орто/пара ориентантом.
Д) 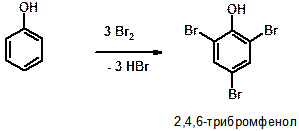
ПОЯСНЕНИЕ: Реакция бромирования фенола. Группа ОН является орто-пара-ориентантом. Помимо этого, группа ОН настолько сильно активирует бензольное кольцо (ускоряет протекание реакции замещения), что при действии бромной воды (раствор брома в воде) замещению подвергается сразу три атома водорода – два атома водорода в орто-положениях и один – в пара-положении.
37. Среди указанных ароматических соединений, укажите: какое из них наиболее реакционоспособно в реакциях электрофильного ароматического замещения, а какое наименее реакционоспособно. Ответ поясните. 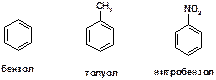
ОТВЕТ: Метильная группа является электронодонорной (проявляет + I‑эффект) и повышает электронную плотность в бензольном кольце, что облегчает атаку электрофильных частиц. Иными словами, метильная группа является активирующим заместителем. Таким образом, наиболее реакционоспособным является молекула толуола.
Напротив, нитробензол – малореакционоспособен, поскольку содержит электроноакцепторную нитро-группу (NO2), обладающую –I и –M эффектами (отрицательным индуктивным и отрицательным мезомерным эффектами). Иными словами, нитро-группа является дезактивирующим заместителем.
38. Какие заместители являются активирующими, то есть ускоряют протекание реакций электрофильного замещения в бензольном кольце?
Ответ: К активирующим заместителям относят группы, являющиеся электронодонорными по отношению к бензольному кольцу. По сути дела, это все орто/пара-ориентанты за исключением атомов галогенов. Примеры таких заместителей: алкильные группы (метил СН3, этил С2Н5 и т.д.), гидроксил (группа ОН), метокси-группа (ОСН3), амино-группа (NH2). Донорность алкильных групп связана с их положительным индуктивным эффектом. Остальные же группы проявляют положительный мезомерный эффект, поскольку содержат неподеленную электронную пару на атоме, непосредственно связанном с бензольным кольцом (атомы кислорода или азота).
39. Какие заместители относятся к дезактивирующими, то есть замедляют протекание реакций электрофильного замещения в бензольном кольце?
Ответ: К дезактивирующим заместителям относят группы, являющиеся электроноакцепторными по отношению к бензольному кольцу. По сути дела, это все мета-ориентанты, а также атомы галогенов. Примеры таких заместителей: F, Cl, Br, I, NO2 (нитро-группа), SO3H (сульфо-группа), CO2H (карбоксильная группа).
40. Поясните протекание следующей реакции:
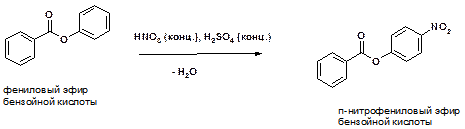
ОТВЕТ: Реакция представляет собой реакцию нитрования, то есть замещения атома водорода на группу NO2 (нитро-группу). Основной вопрос заключается в том, какой именно атом водорода подвергнется замещению. Реакция протекает по более реакционоспособному бензольному кольцу, то есть по активированному – связанному с активирующим заместителем. В качестве активирующего заместителя выступает атом кислорода, имеющий неподеленную электронную пару и потому обладающий +М (положительным мезомерным эффектом). Этот заместитель направляет реакцию замещения в орто и пара положения. Преимущественное образование пара-изомера можно пояснить стерическими (пространственными) препятствиями при протекании реакции по орто-положению.
Напротив, второе бензольное кольцо (на рисунке находится слева) является дезактивированным, поскольку непосредственно связано с карбонильной группой (С=О), являющейся электроноакцепторной.
41. Какой тип реакций наиболее характерен для алкилгалогенидов (моногалогенпроизводных алканов)?
ОТВЕТ: Для алкилгалогенидов наиболее характерны реакции замещения. С точки зрения механизма эти реакции относят к реакциям нуклеофильного замещения, поскольку один нуклеофил (частица с неподеленной электронной парой) замещает другой нуклеофил (атом галогена, связанный электронной парой с атомом углерода).

На приведенной схеме происходит нуклеофильное замещение при атоме углерода, атом брома уходит вместе с электронной парой, то есть по сути отщепляется бромид-анион (связь C-Br рвется гетеролитически).
42. Что такое первичные, вторичные и третичные алкилгалогениды?
ОТВЕТ: Деление галогенидов на первичные, вторичные и третичные осуществляется на основании количества связей С-С, образуемых атомом углерода, непосредственно связанном с атомом галогена. К примеру, бромэтан представляет собой первичный галогенид 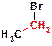 , поскольку атом углерода, образующий связь C-Br образует лишь одну связь С-С.
, поскольку атом углерода, образующий связь C-Br образует лишь одну связь С-С.
Примером вторичного галогенида может служить изопропилбромид (2‑бромпропан) 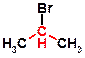 , а примером третичных галогенидов является трет‑бутилбромид
, а примером третичных галогенидов является трет‑бутилбромид 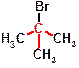 . АНАЛОГИЧНО ГАЛОГЕНИДАМ НА ПЕРВИЧНЫЕ, ВТОРИЧНЫЕ И ТРЕТИЧНЫЕ ДЕЛЯЕТСЯ И СПИРТЫ.
. АНАЛОГИЧНО ГАЛОГЕНИДАМ НА ПЕРВИЧНЫЕ, ВТОРИЧНЫЕ И ТРЕТИЧНЫЕ ДЕЛЯЕТСЯ И СПИРТЫ.
43. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
ОТВЕТЫ:
А) 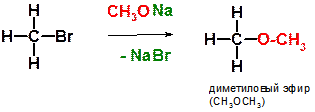
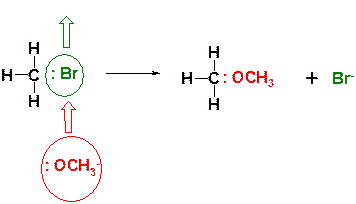
Пояснение: реакция является примером синтеза простых эфиров по Вильямсону и представляет собой реакцию нуклеофильного замещения. Метилат натрия (СН3ОNa) является солеобразным соединением и диссоциирует на ионы: 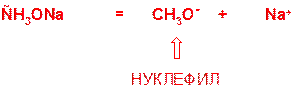
Образующийся при этом метилат-анион (СН3О-) атакует по атому углерода, замещая при нем бромид-анион (уходящую группу).
Б) 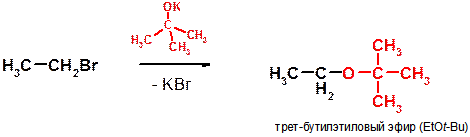
Пояснение: реакция является примером синтеза простых эфиров по Вильямсону и представляет собой реакцию нуклеофильного замещения. Для правильного написания продукта необходимо правильно указывать структуру нуклеофила: место атома брома занимает атом кислорода, поскольку именно атом кислорода содержал неподеленную электронную пару и являлся нуклеофильным центом трет-бутилат-аниона.
В) 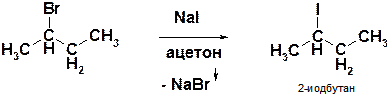
Пояснение: получение алкилиодидов действием раствора иодида натрия в ацетоне (ренакция Финкельштейна). Равновесие реакции сдвинуто вправо из-за низкой растворимости бромида натрия в ацетоне.
Г) 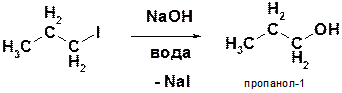
Пояснение: Нуклеофилом служит гидроксид-анион (ОН-), реакция позволяет переводить галогениды в соответствующие спирты.
Д) 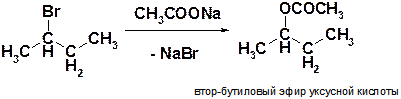
Пояснение: получение сложных эфиров реакцией нуклеофильного замещения. Нуклеофилом служит ацетат-анион (СН3СОО-), нуклеофильным центром в котором является атом кислорода. Важно правильно указывать порядок атомов во входящем нуклеофиле. Структурная формула продукта реакции: 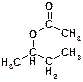 .
.
Е) 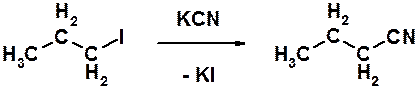
Пояснение: синтез нитрилов карбоновых кислот (органических цианидов) реакцией нуклеофильного замещения.
Ё) 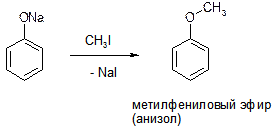
Ж) 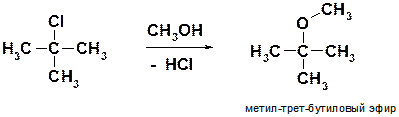
Пояснение: Если атакующим нуклеофилом является не солеобразное вещество, а нейтральная молекула (в данной реакции – молекула метанола СН3ОН), то выделяется не соль (NaCl, NaBr), как было в предыдущих реакциях, а галогеноводород (HCl, HBr). В данной реакции нуклеофильным центром является атом кислорода молекулы метанола СН3ОН, поскольку на двухвалентном кислороде всегда имеется две неподеленные электронные пары. Молекула метанола как нуклеофил атакует молекулу галогенида, причем связь С-Cl замещаеся на связь С-О.
З) 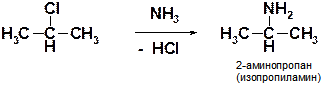
Пояснение: Смотри предыдущую реакцию. Следует учесть, что молекула аммиака (NH3) является нуклефоильной, так как на трехвалентном азоте всегда имеется неподеленная электронная пара (одна).
И) 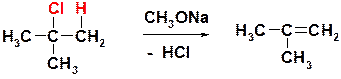
Пояснение: некоторые реакции галогенидов с солеобразными веществами идут не по пути нуклеофильного замещения. Самым важным таким случаем является взаимодействие третичных (и вторичных) алкилгалогенидов с сильными основаниями, когда доминирующим процессом становится реакция отщепления галогеноводорода (реакция элиминирования). В описанной выше реакции происходит дегидрохлорирование- отщепление хлороводорода (HCl).
К типичным сильным основаниям относятся алкоголяты щелочных металлов (ROK, RONa), к примеру, метилат натрия СН3ОNa. Это основание связывает выделяющийся хлороводород по уравнению:
CH3 ONa + HCl = CH3 OH + NaCl
Что и является движущей силой процесса. Следует заметить, что если на то же самое исходное вещество (третичный галогенид) действовать не метилатом натрия СН3ОNa, а метанолом СН3ОН (не являющимся сильным основанием), то протекает обычная реакция нуклеофильного замещения (пояснения смори выше): 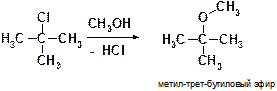
44. Какие примеры сильных оснований Вы знаете?
Ответ: Сильными основаниями являются вещества, взаимодействующие с кислотами (источниками протонов Н+) с образованием малодиссоциированых соединений. Из неорганических веществ стоит упомянуть щелочи (NaOH, KOH), являющиеся источником гидроксид-аниона ОН-. Гидроксид-анион взаимодействует с протоном (или отрывает его от слабой кислоты) с образованием воды: Н+ + ОН- = Н2О
Еще более сильным неорганическим основанием является амид натрия NaNH2, дающий при диссоциации амид-анион NH2-. При взаимодействии этого аниона с протоном (Н+) образуется молекула аммиака- еще менее диссоциированное соединение, чем вода.
Из органических сильных оснований стоит упомянуть алкоголяты щелочных металлов (RONa, ROK), представляюшие собой соли соответствующих спиртов. Эти соединения по своей основности занимают промежуточное место между щелочами и амидами. Причиной основности является алкоголят-анион RO-, связывающий протон с образованием малодиссоциированной молекулы спирта ROH.
45. Что Вы знаете про кислотные свойства спиртов?
Ответ: Связь О-Н в спиртах является полярной, причем электроны связи сдвинуты к более электроотрицательному кислороду. Благодаря этому этой связи характерен гетеролитический тип разрыва. К примеру, он происходит в процессе диссоциации. Тем не менее, спирты ROH являются слабыми кислотами (то есть они малодиссоциированы), равновесие их диссоциации сдвинуто влево:

Таким образом, основная часть спирта находится в виде недиссоциированных молекул. Спирты диссоциированы еще в меньшей степени, чем вода, то есть являются еще более слабыми кислотами, чем вода. Константа диссоциации для спиртов составляет порядка 10-16 – 10-18. Наиболее слабые кислотные свойства проявляют третичные спирты, наиболее сильные – первичные (а также метанол).
Примером реакций, отражающих слабые кислотные свойства спиртов является взаимодействие с наиболее активными металлами – щелочными металлами, приводящее к выделению водорода и образованию солеобразного вещества – алкоголята щелочного металла:
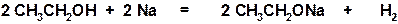
Образующийся в этой реакции этилат натрия напротив является сильным основанием, поскольку этилат-анион связывает протон с образованием малодиссоциированного соединения – молекулы спирта:

46. Что Вы знаете про кислотные свойства фенолов?
Ответ: Фенолы – соединения, в которых гидроксильная группа ОН связано с бензольным кольцом или другой ароматической системой. Простейший представитель – сам фенол: 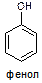 .
.
Фенолы являются слабыми кислотами, однако их кислотные свойства выражены в гораздо большей степени, чем у спиртов. Так константа диссоциации фенола равна порядка 10-10, то есть на 6-8 порядков превосходит константу кислотности воды и спиртов.
Следствием этого является способность фенола взаимодействовать не только со щелочными металлами, но также и со щелочами. К примеру, при взаимодействии фенола с гидроксидом натрия образуется фенолят натрия (натриевая соль фенола) и вода: 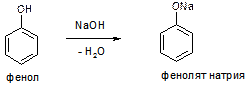
Это отличает фенолы от спиртов, для которых равновесие аналогичной реакции смещено влево, поскольку алкоголят ион RO- является более сильным основанием:
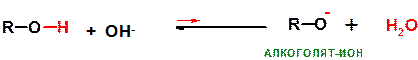
47. Каковы особенности реакций нуклеофильного замещения гидроксильной группы в спиртах?
Ответ: Связь С-О в спиртах является полярной и напоминает связь С‑Hal в алкилгалогенидах: этой связи также характерен гетеролитический разрыв. Таким образом, спиртам характерны реакции нуклеофильного замещения:

Особенности поведения спиртов в этих реакциях связаны с тем, что гидроксид-анион является плохой уходящей группой (это связано с высокой основностью этого аниона). Для облегчения протекания этих реакций их обычно проводят в кислой среде, где уходящей группой является не гидроксид-анион, а молекула воды – сравнительно хорошая уходящая группа. 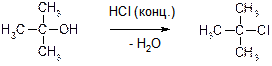
Другой возможностью вовлекать спирты в реакции нуклеофильного замещения является их первоначальное превращение в активированные производные – так называемые мезилаты и тозилаты.
48. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
ОТВЕТЫ:
А) 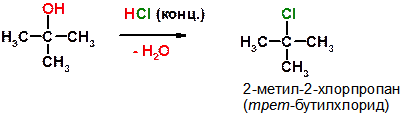
Б) 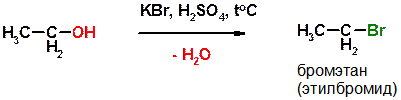
Пояснение: Вместо бромистоводородной кислоты (HBr) можно использовать раствор бромида натрия (или калия) в серной кислоте.
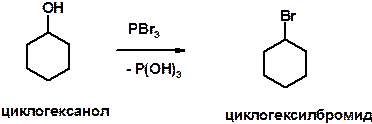
Пояснение: для замены группы ОН на галоген широко используются такие соединения как PCl3, PBr3, PI3 (или смесь P и I2), SOCl2 (тионилхлорид).
В) 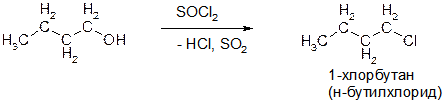
Пояснение: смотри предыдущую реакцию.
Г) 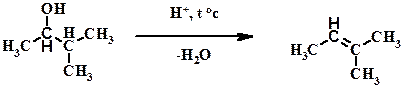
Пояснение: при нагревании в присутствии кислот спирты подвергаются дегидратации (отщеплению воды). Эта реакция является обратной по отношению к реакции гидратации алкенов. В ходе дегидратации от двух соседних атомов углерода отщепляются группы ОН и Н (в целом Н2О-вода), а между двумя соседними углеродами формируется двойная связь. В реакции дегидратации выполняется правило Зайцева (смотри в начале документа): водород отщепляется от наименее гидрогенизированного атома углерода (преимущественно от третичного, в случае его отсутствия – от вторичного).
Д) 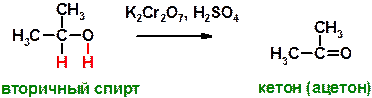
Пояснение: спирты подвергаются окислению под действием типичных окислителей. Вторичные спирты при этом превращаются в кетоны, стойкие к действию окислителей. В процессе реакции от молекулы спирта как бы отщепляется два атома водорода, а между двумя атомами – углеродом и кислородом, от которых отщепляется по атому водорода, образуется дополнительная связь (π-связь, «пи»-связь).
Е) 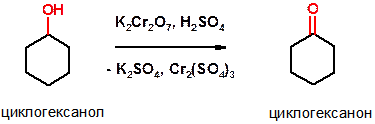
Пояснение: смотри предыдущую реакцию.
Ж) 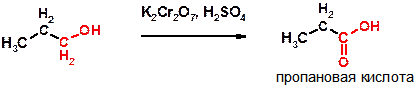
Пояснение: первая стадия окисления первичных спиртов сходна с окислением вторичных спиртов: от спирта суммарно отщепляется два атома водорода и формируется карбонильная группа С=О.
 Однако при окислении первичных спиртов на первой стадии образуется альдегид, легко подвергающийся дальнейшему окислению до карбоновой кислоты- конечного продукта реакции.
Однако при окислении первичных спиртов на первой стадии образуется альдегид, легко подвергающийся дальнейшему окислению до карбоновой кислоты- конечного продукта реакции.
49. Что такое многоатомные спирты? Приведите примеры.
Ответ: Двухатомными называют соединения, содержащие две спиртовые группы ОН, трехатомными - три и т.д.
Примером двухатомного спирта может служить этиленгликоль, а трехатомного –глицерин. 
50. Каково строение молекул жиров? Остатки каких кислот входят в их состав?
Ответ: жиры представляют собой сложные эфиры глицерина и высших карбоновых кислот. Общая формула жиров 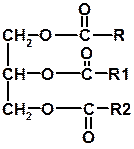 .
.
Остатки R, R1 и R2 могут быть одинаковыми или разными, часто это алкильные группы нормального (неразветвленного строения): н-С15Н31 или н-С17Н35.
Типичными кислотами, образующими молекулы жиров являются пальмитиновая и стеариновая кислоты:
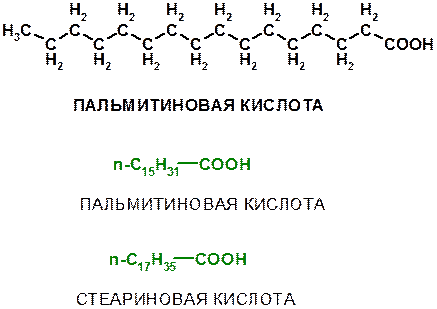
51. Приведите механизм реакции присоединения хлороводорода к молекуле этилена: 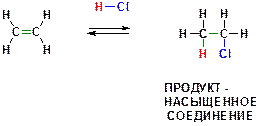
Ответ: Алкенам характерны реакции электрофильного присоединения (AdE, Addition Electrophilic). Механизм может быть представлен следующим образом:
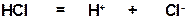
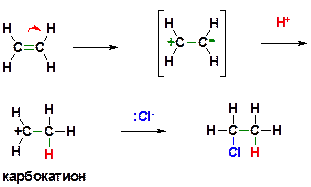
ПОЯСНЕНИЕ: ХЛОРОВОДОРОД ДИССОЦИИРУЕТ НА ПРОТОН И ХЛОРИД-АНИОН (ХЛОРОВОДОРОД- СИЛЬНАЯ КИСЛОТА). ПОСЛЕДУЮЩЕЕ ПРИСОЕДИНЕНИЕ ЭЛЕКТРОФИЛА (ЧАСТИЦЫ С ВАКАНТНОЙ ОРБИТАЛЬЮ) К ДВОЙНОРЙ СВЯЗИ МОЖЕТ ОСУЩЕСТВЛЯТЬСЯ ЛИШЬ ПУТЕМ ГЕТЕРОЛИТИЧЕСКОГО РАЗРЫВА π-СВЯЗИ («ПИ»-СВЯЗИ). ОБРАЗУЮЩИЙСЯ ПОСЛЕ ПРИСОЕДИНЕНИЯ ПРОТОНА (Н+) ЭТИЛЬНЫЙ КАТИОН ЯВЛЯЕТСЯ ЭЛЕКТРОФИЛЬНОЙ ЧАСТИЦЕЙ (так как содержит вакантную орбиталь на положительно заряженном атоме углерода) и реагирует с нуклеофильным хлорид-анионом, образуя связь С-Cl по донорно-акцепторному механизму и приводя к конечному продукту реакции.
52. Какова теоретическая интерпретация правила Марковникова?
Ответ: Правило Марковникова гласит, что в реакциях присоединения галогеноводородов (HHal) и воды (Н2О) атом водорода присоединяется к более гидрогенизированному атому углерода.
Рассмотрим эту стадию на примере присоединения протона к молекуле изобутилена. С точки зрения механизма реакции, на первой стадии процесса происходит присоединение протона (Н+), причем можно представить себе два пути присоединения к несимметричным алкенам:

В любом случае суть первой стадии сводится к: 1. Разрыву π-связи (гетеролитическому). 2. Присоединению протона к одному из двух углеродных атомов, которые ранее образовывали эту π-связь. 3. Формированию на втором углеродном атоме (который остался трехвалентным) формального целочисленного положительного заряда (+).
Как видно из вышеприведенной схемы при присоединении протона к молекуле изобутилена могут альтернативно образовываться два изомерных катиона: трет‑бутильный или изобутильный. Трет-бутильный катион более стабилен по сравнению с первичным изобутильным катионом, поскольку является третичным (карбокатионный центр С+ образует три связи С-С).
Реакция идет именно через более стабильный катион, то есть по пути, изображенному в верхней части схемы, то есть именно по правилу Марковникова, ведь для образования трет-бутильного катиона протон присоединился именно к более гидрогенизированному атому углерода. Последующее присоединение хлорид-аниона приводит к конечному продукту реакции.
52. Известно, что ряд стабильности алкильных катионов имеет следующий вид:









