Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.
1. Какие соединения относят к алканам?
Ответ: Алканы – это углеводороды (то есть вещества, состоящие из углерода и водорода), построенные исключительно из одинарных связей С-С и С-Н. Состав алканов отвечает общей формуле СnH2n+2, где n – это целое число (1, 2, 3 и т.д.).
2. Приведите структурные формулы и названия алканов нормального строения, содержащие от одного до шести атомов углерода.
Ответ:
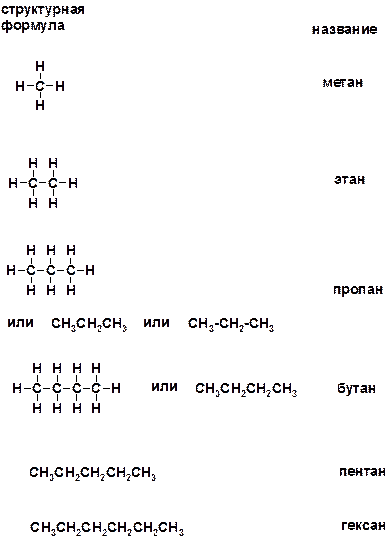
3. Рядом приведена структурная формула бутана. 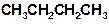 Объясните, как Вы понимаете утверждение, что каждый атом углерода в этом соединении четырехвалентен?
Объясните, как Вы понимаете утверждение, что каждый атом углерода в этом соединении четырехвалентен?
Ответ: Валентность – это способность атома образовывать определенное количество химических связей. Известно, что атом углерода – четырехвалентен, а водорода – одновалентен. Это видно из полной структурной формулы бутана:
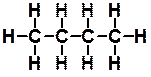 Видно, что каждый атом углерода образует четыре связи (условно обозначаемых черточками). Однако для краткости обычно используют сокращенные формулы, в которых не изображают по отдельности каждую из связей С‑Н. При этом структурная формула бутана выглядит следующим образом:
Видно, что каждый атом углерода образует четыре связи (условно обозначаемых черточками). Однако для краткости обычно используют сокращенные формулы, в которых не изображают по отдельности каждую из связей С‑Н. При этом структурная формула бутана выглядит следующим образом: 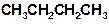 .
.
4. Что такое метильная, этильная, н-пропильная и изопропильная группы?
Ответ: Алкан состава CnH2n+2 можно рассматривать как атом водорода Н, связанный с алкильной группой CnH2n+1. Таким образом, алкильная группа – одновалентный остаток, отвечающий общей формуле CnH2n+1. Такие группы являются фрагментами большинства органических соединений. Типичные алкильные группы необходимо запомнить. Их названия строятся путем замены окончания «ан» в соответствующем алкане на окончание «ил». Примеры:
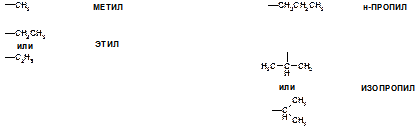
То, что имеется н-пропильная (нормальная пропильная) и изопропильная группа связано с тем, что атом водорода от молекулы пропана 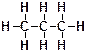 можно оторвать одним из двух способов: либо от центрального атома углерода (тогда получается изопропильная группа), либо от одного из крайних атомов углерода (тогда получается н-пропильная группа).
можно оторвать одним из двух способов: либо от центрального атома углерода (тогда получается изопропильная группа), либо от одного из крайних атомов углерода (тогда получается н-пропильная группа).
5. Приведите систематические названия для следующих соединений:
А) 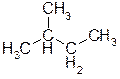 ОТВЕТ: 2-метилбутан. ПОЯСНЕНИЕ: Выбирается самая длинная углеродная цепь и нумеруется с того конца, к которому ближе находится заместитель (метильная группа). В данном случае за основу названия берется «бутан», т.к. алкан из четырех атомов углерода - это именно «бутан». По сравнению с бутаном в нашем соединении имеется метильная группа при втором атоме углерода, поэтому соединение называется 2-метилбутан.
ОТВЕТ: 2-метилбутан. ПОЯСНЕНИЕ: Выбирается самая длинная углеродная цепь и нумеруется с того конца, к которому ближе находится заместитель (метильная группа). В данном случае за основу названия берется «бутан», т.к. алкан из четырех атомов углерода - это именно «бутан». По сравнению с бутаном в нашем соединении имеется метильная группа при втором атоме углерода, поэтому соединение называется 2-метилбутан.
Б) 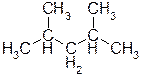 Ответ: 2,4-диметилпентан. Пояснение: цифры 2 и 4 обозначают положение двух метильных групп, а приставка «ди» в названии означает то, что этих групп две.
Ответ: 2,4-диметилпентан. Пояснение: цифры 2 и 4 обозначают положение двух метильных групп, а приставка «ди» в названии означает то, что этих групп две.
В) 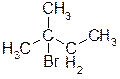 Ответ: 2-бром-2-метилбутан.
Ответ: 2-бром-2-метилбутан.
Г) 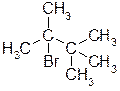 Ответ: 2-бром-2,3,3-триметилбутан.
Ответ: 2-бром-2,3,3-триметилбутан.
6. Изобразите структурные формулы следующих соединений:
А) 3-метилгексан. Ответ: 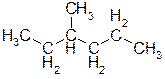
Б) 2-бромбутан. Ответ: 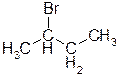
В) циклогексан. Ответ: 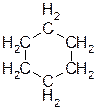
Г) метилциклогексан. Ответ: 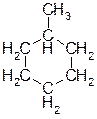
7. Какие реакции наиболее характерны для алканов?
Ответ: Реакции замещения. В этих реакциях атом водорода замещается на какой-либо другой атом или группу атомов. Пример: фотохимическое хлорирование метана. В этой реакции атом водорода замещается на атом хлора.
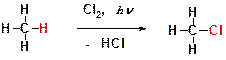
8. Приведите структурную формулу 2-метилбутана и укажите первичные, вторичные и третичные атомы углерода.
Ответ: 
Пояснение: Отнесение атома углерода к первичным, вторичным или третичным делается на основании количества связей С-С (углерод-углерод), которое образует данный углеродный атом. Так, на схеме, атом углерода, обозначенный как «третичный» образует три связи С-С (и соответственно, лишь одну связь С-Н). Эти связи С-С изображены в виде черточек.
Напротив, атомы углерода метильных групп (СН3) образуют лишь одну связь С-С (и три связи С-Н) и являются первичными. Атомы водорода при третичном углеродном атоме называют третичными атомами водорода, при вторичном – вторичными, при первичном - первичными
9. Что Вы знаете про закономерности, характерные для реакции бромирования алканов? С чем связаны эти закономерности?
Ответ: Замещению подвергаются прежде всего третичные атомы водорода, и лишь если таковых нет – вторичные, а затем и первичные. Это связано с тем, что реакция протекает по радикальному механизму и стремится идти через наиболее стабильный радикал. Третичные же радикалы – наиболее стабильные из всех алкильных.
10. Приведите продукты фотохимического бромирования следующих алканов: ОТВЕТ:
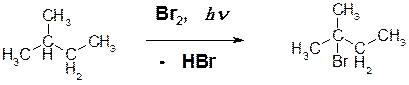
Пояснение: в вышеприведенной реакции подвергся замещению третичный атом водорода.
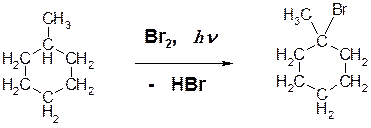 Пояснение: заместился третичный атом водорода.
Пояснение: заместился третичный атом водорода.
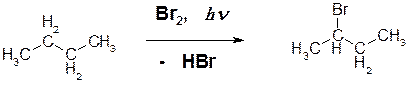 Пояснение: в молекуле бутана нет третичных атомов водорода, зато есть вторичные, которые и подвергаются замещению. При этом обе группы СН2 молекулы бутана – идентичны и в какой бы из них не произошло замещение водорода на бром в любом случае получается один и тот же продукт – 2-бромбутан.
Пояснение: в молекуле бутана нет третичных атомов водорода, зато есть вторичные, которые и подвергаются замещению. При этом обе группы СН2 молекулы бутана – идентичны и в какой бы из них не произошло замещение водорода на бром в любом случае получается один и тот же продукт – 2-бромбутан.
11. Как Вы понимаете смысл приведенной ниже схемы? Где в ней указан субстрат, реагент, что означает надпись «- HBr» под стрелкой?
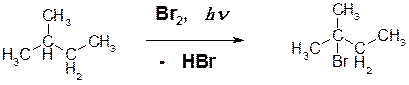
ОТВЕТ: 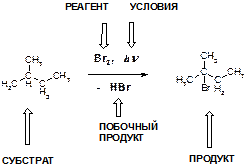
Надпись «- HBr» означает, что бромоводород является продуктом реакции (то есть при записи уравнения находится в правой части), знак «минус» по сути означает, что это соединение выделяется в ходе процесса.
12. Способен ли бутан существовать в виде цис и транс-изомеров? Что такое конформации?
Ответ: Нет. Дело в том, что относительно всех одинарных связей возможно относительно свободное вращение.

Таким образом, это вращение происходит и относительно центральной связи углерод-углерод. Формы молекулы, возникающие за счет свободного вращения относительно одинарных связей, называются конформациями. Для бутана эти конформации называют заслоненной и заторможенной. Важно то, что в отличие от цис и транс-изомеров, которые не могут легко переходить друг в друга эти две конформации бутана легко переходят друг в друга.
13. Каково строение атома водорода? Какова электронная конфигурация атома водорода? Какие частицы образуются: а) при отрыве одного электрона от атома водорода; б) при присоединении одного электрона к атому водорода? Какая из образующихся частиц имеет вакантную орбиталь, а какая – неподеленную электронную пару?
Ответ:
Любой атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, окружающих ядро. Положительный заряд ядра обусловлен наличием в нем протонов, заряд каждого протона +1. Атом в целом электронейтрален, поскольку положительный заряд ядра компенсирован отрицательным зарядом электронов (заряд каждого электрона равен ‑1).
Порядковый номер атома в Таблице Менделеева численно равен количеству протонов в ядре атома и количеству электронов, окружающих ядро атома. Это и обуславливает электронейтральность атома.
К примеру, водород – первый элемент таблицы Менделеева. Его ядро содержит один протон, а вокруг ядра движется один электрон. В атоме углерода (элемент № 6) заряд ядра равен +6 (т.к. содержит шесть протонов), причем каждый атом углерода содержит шесть электронов, компенсирующих положительный заряд ядра.
Электроны в атомах располагаются на орбиталях. Так, единственный электрон атома водорода располагается на так называемой 1s-орбитали. Поскольку электрон на орбитали один, то говорят, что атом водорода содержит неспаренный электрон. Электронная конфигурация атома водорода 1s1 (указывается орбиталь и количество электронов на ней).
Если от атома водорода оторвать отрицательно заряженный электрон, то останется положительно заряженная частица – ион водорода H+ или, как ее чаще называют, протон (так как мы оторвали единственный электрон, который был в атоме водорода и после этого от атома водорода осталось только его ядро, представляющее собой один протон). Протон имеет вакантную (пустую) 1s-орбиталь, на которой раньше (в атоме водорода) располагался электрон.
На одной орбитали может разместиться не более двух электронов. Поэтому, если электронейтральный атом водорода присоединяет отрицательно заряженный электрон, то образуется отрицательно заряженная частица (заряд ‑1) – так называемый гидрид‑анион, обозначаемый Н‑. Эта частица имеет отрицательный заряд, так как содержит один протон (ядро атома водорода) и два отрицательно заряженных электрона. Эти электроны располагаются на 1s-орбитали и электронная конфигурация гидрид-аниона 1s2. Поскольку два электрона располагаются на одной орбитали, то говорят, что гидрид-анион содержит неподеленную электронную пару.

14. Напишите формулу электронной конфигурации атома углерода в основном и возбуждённом состоянии. Какова валентность углерода в органических соединениях? Приведите структурные формулы следующих соединений:
-метан, этан; этилен (этен), пропилен (пропен);
-ацетилен (этин), пропин; бензол;
-метанол, этанол;
Ответ:
Атом углерода (шестой элемент таблицы Менделеева, содержит шесть электронов) в основном, невозбуждённом состоянии, имеет формулу электронной оболочки 1s22s22p2. Для нас наиболее важны электроны внешнего (в данном случае второго) уровня, так называемые «валентные» электроны, потому что именно они участвуют в химических реакциях; в невозбуждённом состоянии это электроны 2s22p2.
При переходе в возбуждённое состояние электронная конфигурация углерода становится 1s22s12p3 , конфигурация внешнего, валентного уровня, как видно из формулы и рисунка, 2s12p3. Всего на валентном, внешнем уровне получается 4 неспаренных электрона, которые участвуют в образовании связей в органических соединениях. Поэтому валентность углерода в органических соединениях всегда 4.
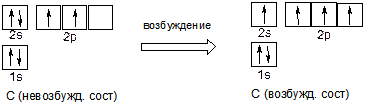
В соответствии с вышеизложенным принципом валентности углерода, равной 4, можно изобразить структурные формулы упомянутых веществ следующим образом:
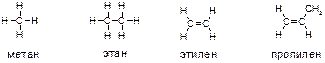
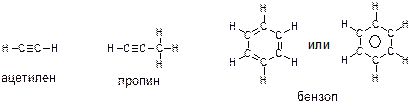
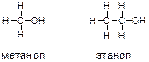
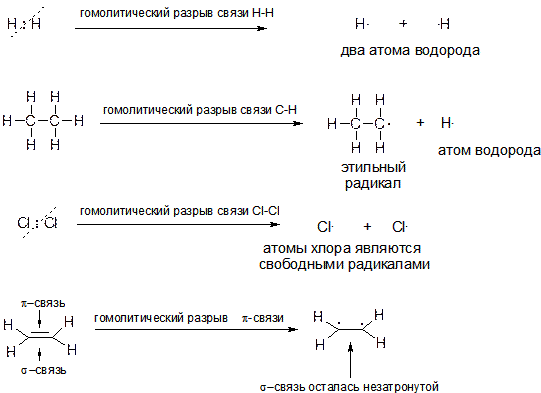
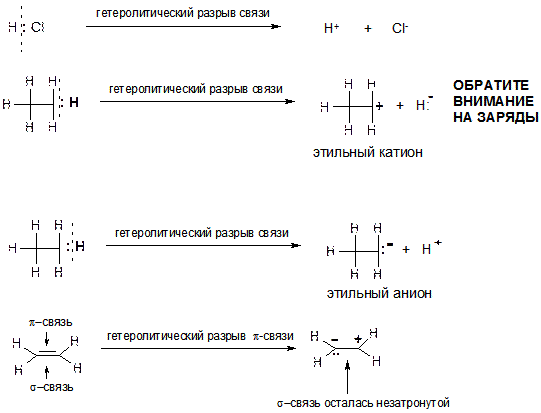
15. Что такое обменный и донорно-акцепторный механизм образования ковалентной связи? Что такое гомолитический и гетеролитический разрывы ковалентной связи? Какие частицы (как они называются) образуются при: а) гомолитическом разрыве связи Н-Н в молекуле водорода Н2; б) гомолитическом разрыве связи С-Н в молекуле этана; в) гетеролитическом разрыве связи H-Cl в молекуле HCl; г) гетеролитическом разрыве связи С-Н в молекуле этана?
Ответ:
В процессе изучения органической химии Вы регулярно встречаетесь с разнообразными химическими реакциями. При их протекании одни вещества (исходные вещества или реагенты) превращаются в другие (продукты реакции). Химические реакции протекают за счет разрыва одних химических связей и образования других связей. Именно поэтому так важно знать способы образования и разрыва химической связи.
Ковалентная связь всегда образуется за счет двух электронов. При изображении структурных формул органических соединений ковалентную связь изображают в виде черточки (‑) или же в виде пары электронов (:).

Существует лишь два механизма образования ковалентной связи: обменный и донорно-акцепторный. При обменном механизме ковалентная связь между двумя атомами образуется за счет двух электронов – по одному неспаренному электрону от каждого из атомов, образующих связь. Примером может служить образование молекулы водорода Н2 из двух атомов водорода. Атомы водорода являются свободными радикалами, поскольку по определению радикал – это частица с одним или несколькими неспаренными электронами.
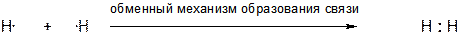
Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.
При донорно-акцепторном механизме ковалентная связь между двумя атомами образуется также за счет двух электронов – неподеленной электронной пары атома-донора и пустой орбитали атома-акцептора. В органической химии частицу с неподеленной электронной парой называют нуклеофилом, а частицу с пустой орбиталью – электрофилом. Таким образом, нуклеофил может взаимодействовать с электрофилом с образованием связи по донорно‑акцепторному механизму. Две нуклеофильные частицы, равно как и две электрофильные частицы не взаимодействуют друг с другом.

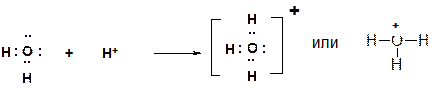
Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда!!!) образуются заряженные частицы ‑ ионы.
16. Что такое электрофил и нуклеофил? Приведите примеры таких частиц.
Ответ: Нуклеофил – частица с неподеленной электронной парой. Чаще всего нуклеофилами являются анионы. К примеру, гидрид анион Н-, хлорид-анион Cl-, гидроксид-анион ОН-. Однако нуклеофильными свойствами обладают также и электронейтральные молекулы. К примеру, молекула воды H2O или метанола CH3OH являются нуклеофилами, поскольку содержат атом кислорода, на котором имеется целых две неподеленных электронных пары (как на любом двухвавлентном кислороде). Аналогично молекула аммиака NH3 и органических аминов нуклеофильны, так как на трехвалентном азоте всегда имеется одна неподеленная электронная пара.
17. Приведите все структурные формулы и названия изомерных соединений следующего состава:
-алканы C5 H12;
-алкены C4 H8;
-спирты C3 H8 O.
Ответ:
алканы состава С5Н12:
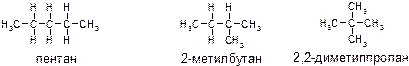
Алкены состава С4Н8:
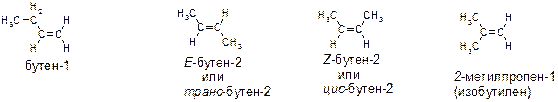
Спирты состава С3Н8О:
 (изопропиловый спирт)
(изопропиловый спирт)
18. Определите тип гибридизации атомов углерода в молекулах метана, этилена, формальдегида, синильной кислоты и ацетилена.
Ответ: Несмотря на постоянную валентность углерода (четыре), он может по‑разному использовать свои валентности в зависимости от количества и валентности связанных с ним атомов. Можно придумать следующие возможные случаи:

Количество соседей, с которыми связан атом углерода, определяет геометрию молекулы. К примеру, молекула синильной кислоты HCN линейна: центральный атом углерода связан одной связью с атомом водорода Н и тройной связью с атомом азота N. Одинарная связь образована двумя электронами, а тройная – шестью. Поскольку электроны отталкиваются друг от друга, то связи С‑Н и С≡N пытаются МАКСИМАЛЬНО оттолкнуться друг от друга в пространстве, образуя между собой угол 180о (больше уже некуда) и обеспечивая линейность молекулы.
Для того, чтобы определить гибридизацию атома четырехвалентного углерода в органическом соединении необходимо посчитать количество атомов, с которым этот атом углерода связан (т.е. количество соседей). Двум соседям (как в молекуле HCN) соответствует sp‑гибридизация (т.к. sp = s1 p1, а 1+1=2 соседа). Трем соседям (как в молекуле формальдегида СН2О) соответствует sp2‑гибридизация (т.к. sp2 = s1 p2, а 1+2=3 соседа). Четырем соседям (как в молекуле метана СН4) соответствует sp3‑гибридизация (т.к. sp3 = s1 p3, а 1+3=4 соседа).
Используя аналогичный подход, легко найти, что атом углерода в молекуле этилена находится sp2 гибридном состоянии, а в молекуле ацетилена – в sp-гибридном.

19. Каково строение молекул метана, этилена и ацетилена, каково значение валентных углов в этих молекулах?
Ответ: строение молекулы тесно связано с гибридизацией атомов углерода. Можно сказать и иначе: строение связано с количеством атомов, с которыми связан атом углерода, а это количество соседних атомов определяет тип гибридизации.
Молекула ацетилена – линейна, каждый атом углерода связан с двумя соседними атомами – углерода и водорода, которые стараются максимально отдалиться друг от друга, что соответствует валентному углу 180о и таким образом линейному строению.

Молекула этилена – плоская, валентный угол составляет порядка 120о. Молекула метана имеет тетраэдрическое строение: атом углерода находится как бы в центре тетраэдра, а атомы водорода – в вершинах этого тетраэдра. Валентный угол составляет 109.5о. 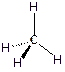
20. Изобразите графически распределение электронов по 2 s и 2 p орбиталям в частицах, полученных а) удалением б) присоединением одного электрона к атому углерода. Какой из этих ионов следует обозначить С‑, а какой С+? Могут ли эти ионы и каким образом проявлять валентность три? Изобразите, какие частицы могут получиться при взаимодействии каждого из этих ионов с тремя атомами водорода. Какую из полученных частиц следует обозначить СН3‑, а какую СН3+?
КРАТКИЙ ОТВЕТ:
А) При удалении одного электрона (заряд электрона -1) образуется катион углерода С+: Эта частица может быть трехвалентной за счет перехода в возбужденное состояние (по аналогии с атомом углерода), поскольку в возбужденном состоянии у иона С+ имеется три неспаренных электрона:
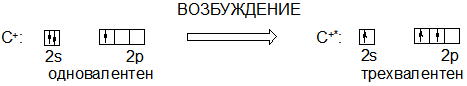
К примеру, при взаимодействии с тремя атомами водорода образуется метильный катион СН3+. Метильный катион –электрофильная частица, поскольку содержит вакантную орбиталь.
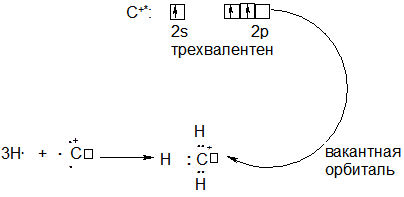
Б) Напротив, если к электронейтральному атому углерода присоединяется электрон, то получается анион углерода С-. Эта частица содержит три неспаренных электрона, а потому способна образовать три связи по обменному механизму, то есть проявлять валентность три. При взаимодействии с тремя атомами водорода образуется метильный анион:
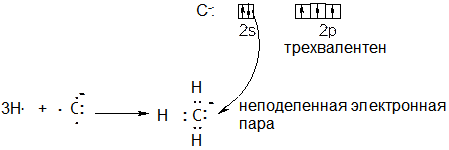
Метильный анион является нуклеофильной частицей, поскольку содержит неподеленную электронную пару на атом углерода.
21. Изобразите электронную формулу молекулы метана и решите, какую связь и каким образом (у какого атома окажутся электроны разрываемой связи?) необходимо разорвать, чтобы получить СН3‑. Проделайте ту же процедуру с целью получить СН3+?
ОТВЕТ:
Необходимо гетеролитически разорвать связь С-Н, поскольку именно при гетеролитическом разрыве связи возникают заряженные частицы. В зависимости от того с каким из атомов – углерода или водорода – останутся два электрона, которые ранее образовывали связь С-Н образуется либо метильный анион либо метильный катион.

22. Какие частицы образуется при гомолитическом разрыве связи С‑Н в молекуле метана? Какое отношение имеют эти частицы к химическим реакциям алканов (в частности, метана)?
Ответ:
При гомолитическом разрыве связи образуются радикальные частицы: атом водорода и метильный радикал.
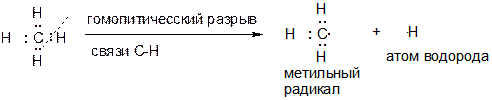
Метильные радикалы являются промежуточными частицами в различных реакциях алканов. К примеру, метильный радикал образуется в качестве промежуточной частицы при хлорировании или бромировании метана.
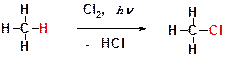
Ряд стабильности алкильных радикалов имеет следующий вид:








