Программа тестового коллоквиума по МКТ и термодинамике
Программа тестового коллоквиума по МКТ и термодинамике
МКТ
1. Записать уравнения состояния ид. газа для всех изопроцессов.
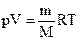
| pV = const | 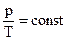
| 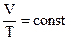
|
2. Изобразить графики всех изопроцессов в координатах p-V, p-T, V-T.
3. Знать влияние Т, V и р на графики в координатах p-V, p-T и V-T соответственно.
4. Знать формулировки законов Авогадро, Дальтона, Гей-Люссака, Бойля-Мариотта, уравнения состояния ид. газа.
5. Что такое число Авогадро?
6. Каково максимальное число степеней свободы одноатомной молекулы, двухатомной молекулы и трехатомной молекулы.
7. Чем характеризуется движение молекул идеального газа согласно МКТ?
а) Хаотичностью направлений движения молекул;
б) Постоянством скоростей молекул;
в) Увеличением интенсивности движения при увеличении температуры;
г) Независимостью интенсивности движения от температуры.
8. Какие утверждения справедливы для идеального газа?
а) между молекулами отсутствуют силы взаимодействия;
б) при столкновении молекул часть их кинетической энергии теряется;
в) собственный объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом;
г) столкновения молекул носят упругий характер.
9. Какова температурная зависимость усредненных скоростей молекул (средней, среднеквадратичной, вероятной)?
~ 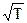
| ~ Т | ~ Т2 | ~ 1/Т |
10. Знать максимальное число степеней свободы для разных молекул.
11. Записать основное уравнение МКТ.
12. Записать среднюю кинетическую энергию одноатомной молекулы, двухатомной молекулы и трехатомной молекулы.
13. Записать законы распределения Максвелла по скоростям молекул и по значениям кинетической энергии молекул.
14. Записать законы распределения Больцмана молекул по высоте и по значениям потенциальной энергии.
15. Знать, как изменяется распределение Максвелла при нагревании и охлаждении газа.
16. Вероятная скорость в замкнутом объеме газа увеличилась в 2 раза. Как и во сколько раз изменилось давление газа?
| Увеличилось в 2 раза | Уменьшилось в 2 раза | Увеличилось в 4 раза | Уменьшилось в 2,5 раза |
17. Знать зависимость графика распределения Больцмана от массы молекул?
18. При температуре Т произошла диссоциация молекул О2 на атомы. Как изменилась вероятная скорость в распределении атомов?
19. Каково соотношение между среднеквадратичной vкв и вероятной vв скоростями молекул одного газа при одинаковой температуре?
20. Как изменится вероятная скорость идеального газа при увеличении температуры в 2 раза?
Термодинамика
1. Записать правильное выражение для теплоемкости тела(m – масса тела, z – число молей вещества, V – объем), удельной теплоемкости, молярной теплоемкости, объемной теплоемкости .
2. Чему равна молярная теплоемкость при постоянном объеме для одно-, двух- и трехатомного газа?
3. Записать формулы для расчета теплоты при изобарическом нагревании 1 моля идеального одно-, двух- и трехатомного газа.
4. Записать формулы для расчета теплоты при изохорическом нагревании 1 моля идеального одно-, двух- и трехатомного газа.
5. В каких процессах внутренняя энергия термодинамической системы не меняется?
| Изохорическое нагревание | Изобарическое охлаждение | Изотермическое расширение. | Адиабатическое сжатие |
6. В каких процессах внутренняя энергия термодинамической системы уменьшается?
7. В каких процессах внутренняя энергия термодинамической системы увеличивается?
8. Записать правильное выражение первого начала термодинамики для изохорического, изобарического, изотермического и адиабатического процессов.
9. Знать все формулировки второго начала термодинамики(по Кельвину, по Клаузиусу, по Больцману).
10. Знать формулировку третьего начала термодинамики.
11. Как соотносятся КПД реальной тепловой машины η с КПД цикла Карно ηк?
12. Какой процесс в термодинамической системе протекает без изменения энтропии?
13. Какие процессы в термодинамической системе протекают с возрастанием энтропии?
| Изохорическое нагревание | Изобарическое охлаждение | Изотермическое сжатие | Адиабатическое расширение |
14. Какие процессы в термодинамической системе протекают с уменьшением энтропии?
15.Записать правильные выражения для изменения энтропии одного моля идеального газа в изохорическом, изобарическом, изотермическом процессах.
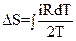
| 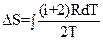
| 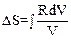
| 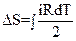
|
16. С именем какого ученого связывают формулу S = klnWT,
где S и WT - энтропия и термодинамическая вероятность?
17. В неком термодинамическом процессе число способов реализации макросостояний системы молекул на микроуровне возрастает. Как изменяется при этом энтропия системы?
| убывает | возрастает | постоянна | или возрастает, или постоянна |
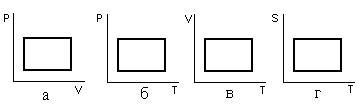
18. Из каких термодинамических процессов состоит цикл Карно?
19. Из приведенных ниже круговых процессов выбрать цикл Карно.
ЗадачиМКТ
1. Баллон емкостью 12 л содержит углекислый газ при р = 1МПа и Т = 318 К. Определить массу газа.
| 0,2 кг | 0,4 кг | 0,6 кг | 0,8кг |
2. При температуре Т = 309 К и давлении р = 0,7 МПа
Плотность газа в баллоне ρ = 12 кг/м3. Какой газ находится в баллоне?
| О2 | СО2 | N2 | NO2 |
3. В баллоне объемом V = 25 л находится водород при Т = 301 К. Когда часть водорода израсходовали, давление понизилось на Δр = 0,4 МПа. Определить массу израсходованного водорода .
| 4 г | 8 г | 10 г | 14 г |
4. Газовая смесь из N2 массой 2 кг и СО массой 8 кг находится в баллоне под давлением р = 1 МПа. Определить парциальные давления азота (р1) и СО (р2).
| р1 = 0,6 МПа р2 = 0,4 МПа | р1 = 0,4 МПа р2 = 0,6 МПа | р1 = 0,2 МПа р2 = 0,8 МПа | р1 = 0,5 МПа р2 = 0,4 МПа |
5. Давление гелия в баллоне р = 1мПа при концентрации молекул n = 1010 см-3. Определить среднюю кинетическую энергию одной молекулы.
| 1·10-19 Дж | 1,2·10-19 Дж | 1,5·10-19 Дж | 2·10-19 Дж |
6. Давление азота в баллоне р = 1мПа при концентрации молекул n = 1010 см-3. Определить среднюю кинетическую энергию одной молекулы.
| 1,2·10-19 Дж | 1,5·10-19 Дж | 2·10-19 Дж | 2,5·10-19 Дж |
7. Давление СО2 в баллоне р = 1мПа при концентрации молекул n = 1010 см-3. Определить среднюю кинетическую энергию одной молекулы
| 3·10-19 Дж | 2,5·10-19 Дж | 2·10-19 Дж | 1,5·10-19 Дж |
8. При температуре 100 К вероятная скорость водорода равна v. При какой температуре гелий будет иметь такую же вероятную скорость?
| 100 К | 150 К | 200 К | 250 К |
9. Два разных газа при одинаковой температуре имеют одинаковую вероятную скорость. Выбрать эти газы.
| H2 и N2 | O2 и N2 | N2 и CO | O2 и CO2 |
10. Газы гелий и кислород находятся при одинаковой температуре. Выбрать верное утверждение отностельно вероятных скоростей газов.
| Vвод < Vгел в 2 раза | Vвод = Vгел | Vвод > Vгел в 2 раза | Vвод > Vгел в 4 раза |
ЗадачиТермод
1. Вычислить удельную теплоемкость сv углекислого газа СО2.
| 657 Дж/кг∙К | 567 Дж/кг∙К | 756 Дж/кг∙К | 675 Дж/кг∙К |
2. Вычислить удельную теплоемкость ср углекислого газа СО2.
| 657 Дж/кг∙К | 567 Дж/кг∙К | 756 Дж/кг∙К | 675 Дж/кг∙К |
3. Для какого двухатомного газа разность удельных теплоемкостей ср - сv = 260 Дж/кг∙К.
| Н2 | N2 | O2 | СО |
4. Вычислить изменение внутренней энергии при изохорическом нагревании азота m = 5 кг на ΔТ = 150 К.
| 775 кДж. | 556 кДж | 755 кДж | 425 кДж |
5. При изобарическом нагревании азоту сообщена теплота Q = 21кДж. Какую работу совершил газ?
| 8 кДж | 6 кДж | 11 кДж | 15 кДж |
6. При изобарическом нагревании азоту сообщена теплота Q = 21кДж. Каково при этом изменение внутренней энергии газа?
| 8 кДж | 6 кДж | 11 кДж | 15 кДж |
7. Водород, расширяясь изобарически, совершил работу А = 6 кДж. Сколько теплоты было подведено к газу?
| 12 кДж | 15 кДж | 18 кДж | 21 кДж |
8 В цикле Карно температура нагревателя Т1 в 3раза больше температуры холодильника Т2.Передаваемая газу теплота за цикл равна 42 кДж. Определить работу А, совершаемую газом за цикл.
| 12 кДж | 24 кДж | 28 кДж | 32 кДж |
9. При изохорическом нагревании одного моля азота давление газа увеличилось в 2 раза. Определить изменение энтропии ΔS газа.
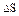 = 7,2 Дж/К = 7,2 Дж/К
| 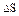 = 8,4 Дж/К = 8,4 Дж/К
| 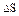 = 9,2 Дж/К = 9,2 Дж/К
| 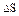 = 14,4 Дж/К = 14,4 Дж/К
|
10. Один моль газа увеличил свой объем в 5 раз сначала изотермически, затем адиабатически. Определить изменение энтропии ΔS газа при переходе из начального состояния в конечное.
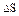 = 7,2 Дж/К = 7,2 Дж/К
| 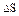 = 8,4 Дж/К = 8,4 Дж/К
| 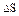 = 13,4 Дж/К = 13,4 Дж/К
| 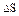 = 17,2 Дж/К = 17,2 Дж/К
|








