14 Число единиц переноса, высота единиц переноса
Величина hоу измеряется в единицах высоты и носит название высоты единиц переноса (ВЕП).
hоу= [G/KyaS] , [м]
Аналогично ВЕП выражается в концентрациях фазы Фх:
hох= L/KxaS
Высота единицы переноса соответствует высоте аппарата, эквивалентной единице переноса. ВЕП обратно пропорциональна объемному коэффициенту массопередачи. Следовательно, чем выше интенсивность массопередачи в аппарате, тем меньше в нем значение ВЕП.
Значения ВЕП часто находят экспериментально.
Интеграл в знаменателе уравнения 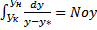 называется числом единиц переноса и обозначается через noy либо noх , если это число отнесено к концентрациям фазы Фу или Фх.
называется числом единиц переноса и обозначается через noy либо noх , если это число отнесено к концентрациям фазы Фу или Фх.
Числа единиц переноса выражаются интегралами или могут быть найдены графически.
15. Понятие теоретической ступени. Определение теоретического числа ступеней изменений концентрации графическим методом.
 Теоретическая ступень (тарелка) – гипотетический участок аппарата, на котором жидкость полностью перемешивается, а концентрации удаляющихся фаз являются равновесными.
Теоретическая ступень (тарелка) – гипотетический участок аппарата, на котором жидкость полностью перемешивается, а концентрации удаляющихся фаз являются равновесными.
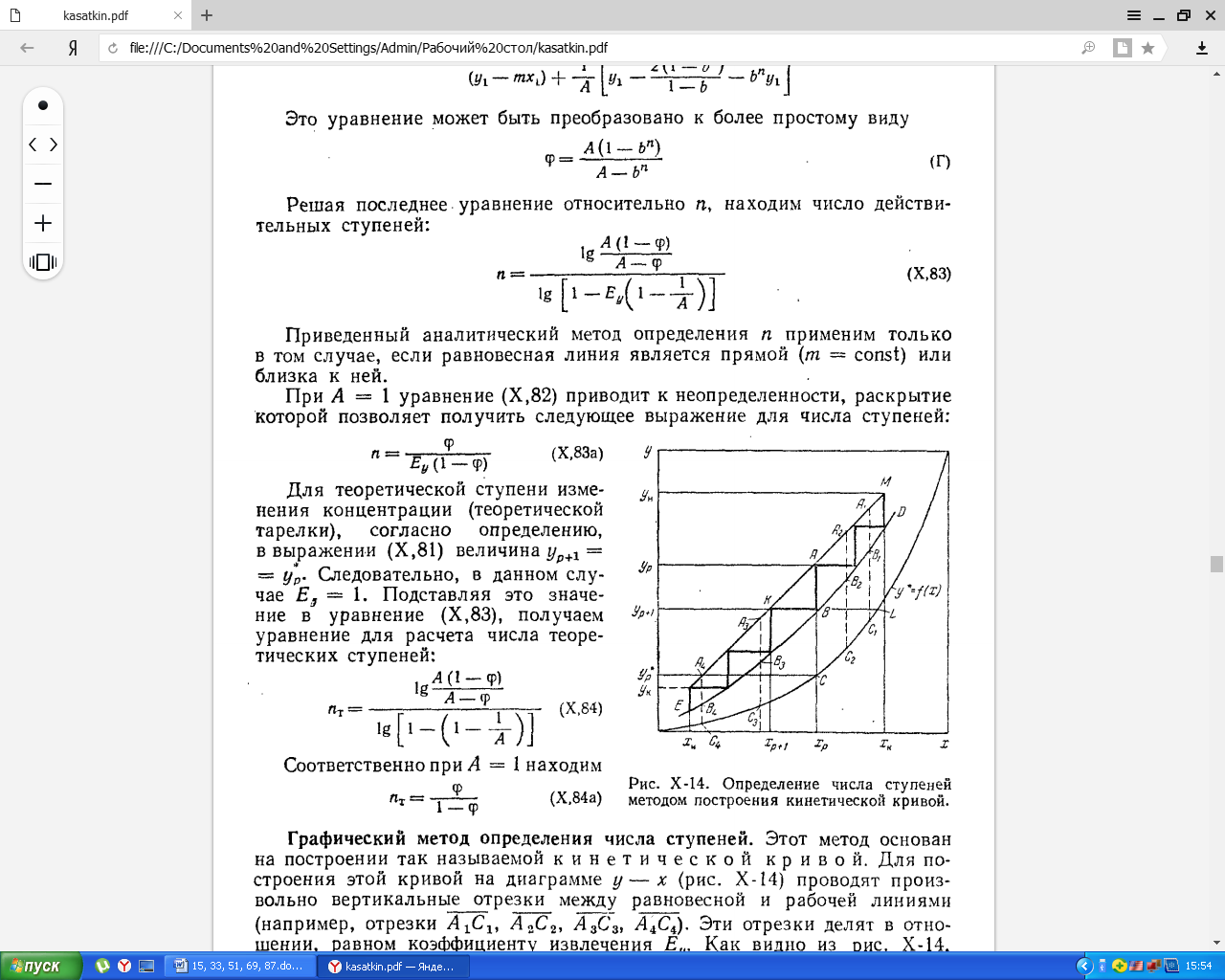
Метод основан на построении так называемой кинетической кривой. Для построения этой кривой на диаграмме y-x проводят произвольно вертикальные отрезки между равновесной и рабочей линиями. Эти отрезки делят в отношении равному коэффициенту извлечения Ey . Далее по известному значению Ey откладывают отрезки АВ. Через полученные точки В проводят кинетическую кривую ДЕ. Затем в пределах от точки М до точки Н вписывают ступеньки между рабочей линией и кинетической кривой. Каждая ступенька состоит из горизонтального отрезка, представляющего собой изменение состава фазы Фx и вертикального отрезка, выражающего изменение состава фазы Фy на реальной ступени. Число ступенек между рабочей линией и кинетической кривой определяет число действительных ступеней массообменного аппарата со ступенчатым контактом.
При Ey =1 кинетическая кривая совмещается с линией равновесия, и путем построения ступенек между рабочей и равновесной линиями можно определить число теоретических ступеней изменения концентрации.
16. Абсорбция, общие понятия. Десорбция.
Абсорбцией называется процесс поглощения газа или пара жидкими поглотителями – абсорбентами. Обратный процесс выделения поглощенного пара называется десорбцией. Растворимость газов зависит от свойств газов и жидкостей, от давления, температуры, от состава газовой фазы, либо от парциального давления компонентов в газе. Согласно правилу фаз, для системы Ж-Г носитель распределяемый компонент число степеней свободы равно 3, следовательно, в состав равновесия при заданном давлении и температуре зависимость между парциальным давлением, либо концентрацией газа в компоненте и состава жидкостей однозначно. Выражается законом Генри.
PA=f(xA) ; yA=f(xA); PA*=E∙xA Парциальное давление компонента А в газе пропорционально его мольной доле в растворе. Десорбция обеспечивает регенерацию абсорбента. К числу основных методов десорбции относят: 1. метод вытеснения; 2. нагрев абсорбента (метод испарения летучих веществ); 3. понижение давления; 4. деструктивный; 5. десорбция с помощью водяного пара
17. Физические основы абсорбции. Закон Генри
Равновесие между фазами. При абсорбции содержание газа в растворе зависит от свойств газа и жидкости, давления, температуры и состава газовой фазы (парциального давления растворяющегося газа в газовой смеси).
В случае растворения в жидкости бинарной газовой смеси (распределяемый компонент А, носитель В) взаимодействуют две фазы (Ф=2), число компонентов равно трем (К — 3) и, согласно правилу фаз, число степеней свободы системы равно трем.
Для данной системы газ—жидкость переменными являются температура, давление и концентрации в обеих фазах. Следовательно, в состоянии равновесия при постоянных температуре и общем давлении зависимость между парциальным давлением газа А (или его концентрацией) и составом жидкой фазы однозначна. Эта зависимость выражается законом Генри:
РА* = ЕхА
18. Материальный баланс абсорбции. Связь между удельным расходом абсорбента и размерами абсорбера.
Примем расходы фаз по высоте аппарата постоянными и выразим содержание поглощаемого газа в относительных мольных концентрациях. Обозначим: G - расход газовой фазы, кмоль/сек; L –расход абсорбента, кмоль/сек; Yн, Yк - содержание абсорбтива в газовой смеси на входе и выходе из аппарата (относительные весовые доли), кмоль/кмоль; Хн, Хк–концентрация абсорбента кмоль/ кмоль.
Тогда уравнение материального баланса будет:
G(Yн - Yк)=L(Хн - Хк)
С увеличением удельного расхода l абсорбента одновременно со снижением высоты аппарата приводит к определенному увеличению его диаметра и увеличению расхода поглотителя L.
19. Тепловой баланс и температура абсорбента. Линия равновесия при неизотермическом процессе.
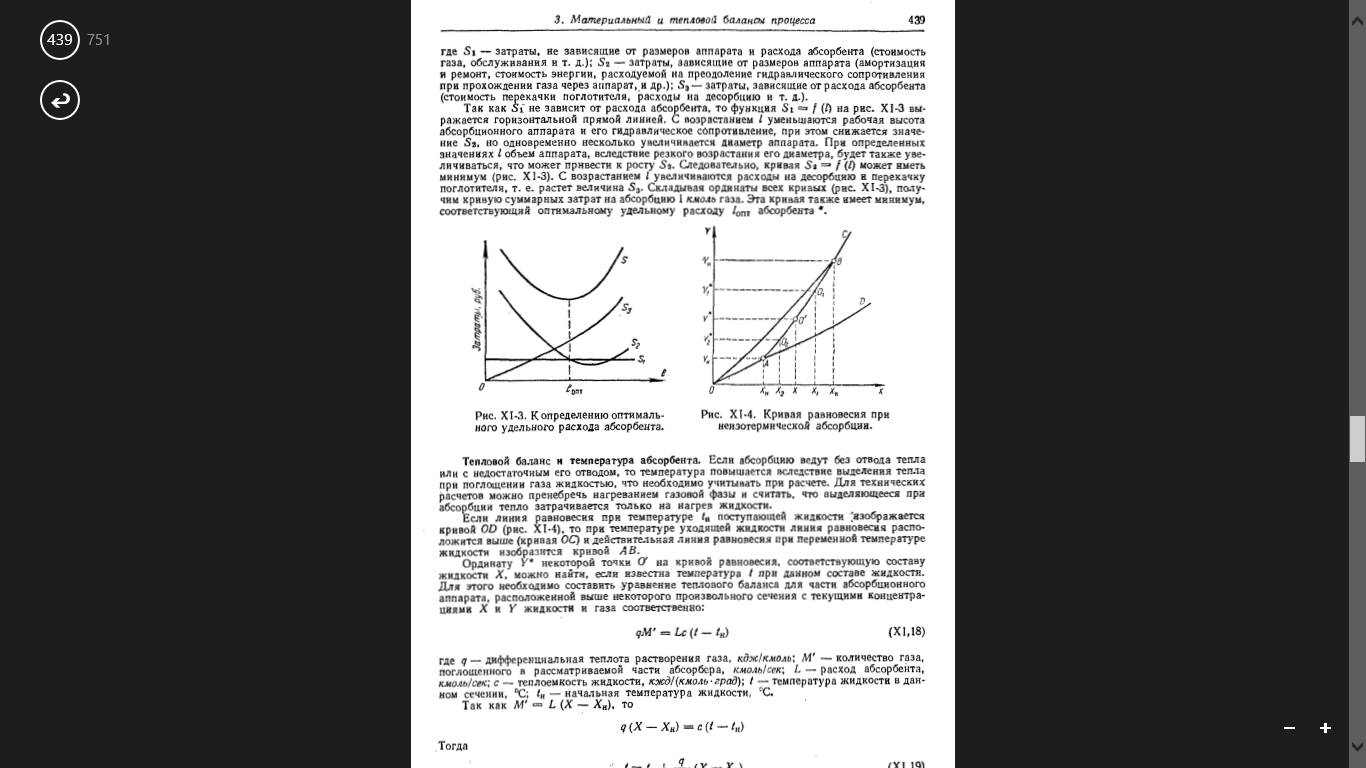 Если абсорбцию ведут без отвода тепла или с недостаточным отводом, то температура повышается вследствие выделения тепла при поглощении газа жидкостью, что учитывается при расчете. Для технических расчетов можно пренебречь нагреванием газовой фазы и считать, что выделяющееся при абсорбции тепло затрачивается только на нагрев жидкости. Если линия равновесия при температуре tн поступающей жидкости изображается кривой OD, то при температуре уходящей жидкости линия равновесия расположится выше (кривая OC), и действительная линия равновесия при переменной температуре жидкости изобразится кривой АВ. Ординату Y* некоторой точки О’ на кривой равновесия, соответствует составу жидкости Х, можно найти, если известна температура t при данном составе жидкости. Для этого необходимо составить уравнение теплового баланса для части абсорбционного аппарата, расположенной выше некоторого произвольного сечения с текущими концентрациями X и Y жидкости и газа соотв-но: qM ’= Lc ( t - t н), где q – дифференциальная теплота растворения газа (кДж/кмоль), M’- количество газа, поглощенного в рассматриваемой части абсорбера (кмоль/сек), L- расход абсорбента (кмоль/сек), c- теплоемкость жидкости (кДж/моль*град), t- темпер жидк в данном сечении (оС),tн - начальная темпер жидк.
Если абсорбцию ведут без отвода тепла или с недостаточным отводом, то температура повышается вследствие выделения тепла при поглощении газа жидкостью, что учитывается при расчете. Для технических расчетов можно пренебречь нагреванием газовой фазы и считать, что выделяющееся при абсорбции тепло затрачивается только на нагрев жидкости. Если линия равновесия при температуре tн поступающей жидкости изображается кривой OD, то при температуре уходящей жидкости линия равновесия расположится выше (кривая OC), и действительная линия равновесия при переменной температуре жидкости изобразится кривой АВ. Ординату Y* некоторой точки О’ на кривой равновесия, соответствует составу жидкости Х, можно найти, если известна температура t при данном составе жидкости. Для этого необходимо составить уравнение теплового баланса для части абсорбционного аппарата, расположенной выше некоторого произвольного сечения с текущими концентрациями X и Y жидкости и газа соотв-но: qM ’= Lc ( t - t н), где q – дифференциальная теплота растворения газа (кДж/кмоль), M’- количество газа, поглощенного в рассматриваемой части абсорбера (кмоль/сек), L- расход абсорбента (кмоль/сек), c- теплоемкость жидкости (кДж/моль*град), t- темпер жидк в данном сечении (оС),tн - начальная темпер жидк.








