3 Равновесие между фазами. Линия равновесия
1. Классификация массообменных процессов.
Массообменными называют процессы, характеризуемые переходом вещества из одной фазы в другую. Обычно под массопередачей понимают переход компонента смеси из области высокой концентрации в область более низкой концентрации. Перенос вещества внутри одной фазы к поверхности раздела или от нее к другой фазе называют массоотдачей. Виды процессов массообмена: 1) Абсорбция – поглощение газа жидкостью 2) Десорбция – выделение газа из жидкости 3) экстракция – извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся с жидкостью 4) Перегонка – разделение гомогенных жидких смесей путем взаимного обмена компонентами между жидкостью и паром, полученным испарением разделяемой жидкой смеси. 5) Адсорбция – поглощение компонента газа, пара или раствора твердым пористым поглотителем т.е. процесс разделения, характеризуемый переходом вещества из газовой или жидкой фазы в твердую. 6) Сушка-удаление влаги из тв материалов, путем ее испарения. 7) Кристаллизация – выделение тв фазы в виде кристаллов из растворов или расплавов. 8) Выщелачивание – извлечение на основе избирательной растворимости одного или нескольких компонентов из твердого пористого материала.
2. Основное уравнение массопередачи.
dM = k ∙ F ∙∆ c ∙ d τ
где M - количество переносимой массы; F – поверхность массопереноса; τ – продолжительность процесса; ∆ c – разность концентраций (ДСП); k – коэффициент массопередачи.
3 Равновесие между фазами. Линия равновесия
Перенос вещества между фазами обусловлен разностью концентраций компонента в контактирующих фазах. При этом между фазами отсутствует равновесие. В результате массообмена концентрация каждого компонента в обеих фазах изменится и в конце концов наступит состояние равновесия. Состояние равновесия следует понимать так, что обмен между фазами не прекращается, однако скорости перехода компонентов из одной фазы в другую выравниваются. В состоянии равновесия между концентрациями любого компонента смеси в обеих фазах имеется определенная зависимость. Так, если в фазе L концентрация компонента х/, а в фазе G- y/*, то в состоянии равновесия y/*=f1(x/) и х/*=f2(y/)
Равновесие между фазами можно представить графически на Y – X-диаграмме (рис. 6.3). На этой диаграмме по оси абсцисс откладывается концентрация X распределяемого вещества в фазе L, а по оси ординат – его концентрация Y в фазе G. Кривая ОС, изображающая зависимость равновесной концентрации Yp от X, называется линией равновесия.
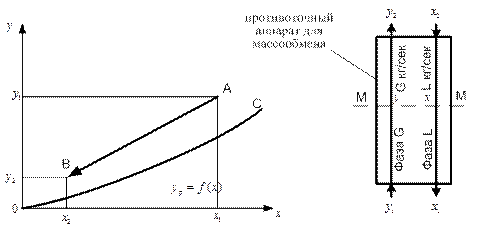
ОС – линия равновесия; АВ – рабочая линия
4. Материальный баланс процессов массообмена. Уравнение рабочей линии.
Рабочие концентрации распределяемого компонента не равны равновесным, и в действующих аппаратах никогда не достигают равновесных значений.
Зависимость между рабочими концентрациями распределяемого вещества в фазах у = f (x) изображается линией, которая носит название рабочей линии процесса. Вид функции у — f (x), или уравнение рабочей линии в его общем виде, является одинаковым для всех массообменных процессов и получается из их материальных балансов.
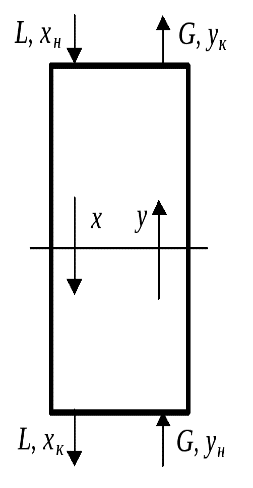 Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис.). Пусть М процесс массопередачи из фазы в фазу, например, из газовой фазы в жидкую, переходит только один распределяемый компонент (скажем, аммиак).
Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис.). Пусть М процесс массопередачи из фазы в фазу, например, из газовой фазы в жидкую, переходит только один распределяемый компонент (скажем, аммиак).
Сверху в аппарат поступает LH кг/сек одной фазы (жидкой), содержащей 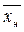 вес. долей распределяемого компонента, а снизу из аппарата удаляется Lk кг/сек той же фазы, содержащей
вес. долей распределяемого компонента, а снизу из аппарата удаляется Lk кг/сек той же фазы, содержащей 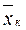 вес. долей распределяемого компонента. Снизу в аппарат поступает Gh кг/сек другой фазы (газовой) концентрацией
вес. долей распределяемого компонента. Снизу в аппарат поступает Gh кг/сек другой фазы (газовой) концентрацией 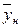 и сверху удаляется Gk кг/сек этой фазы, имеющей концентрацию
и сверху удаляется Gk кг/сек этой фазы, имеющей концентрацию 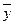 к вес. долей распределяемого компонента.
к вес. долей распределяемого компонента.
Тогда материальный баланс по всему веществу
Gн + Lн = Gк + Lк
и материальный баланс по распределяемому компоненту
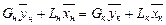
Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/сек, а их текущие концентрации равны 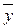 и
и 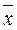 соответственно.
соответственно.
Материальный баланс по всему веществу
Gн + L = G + Lк
и материальный баланс по распределяемому компоненту
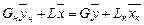
Решая это уравнение относительно 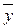 , получим
, получим
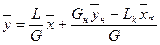 (XIV,1)
(XIV,1)
Уравнение (XIV,1) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Расходы фаз постоянны по высоте аппарата, например, в процессах ректификации, когда числа молей компонентов, которыми обмениваются фазы, равны. В других случаях, если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т.е. принять L = const и G = const. При этом Lк = L, Gн = G и уравнение (Х,1) приводится к виду
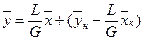 (XIV.1a)
(XIV.1a)
Вводя обозначения 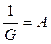 и
и 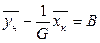 , находим
, находим
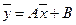 (XIV.1б)
(XIV.1б)
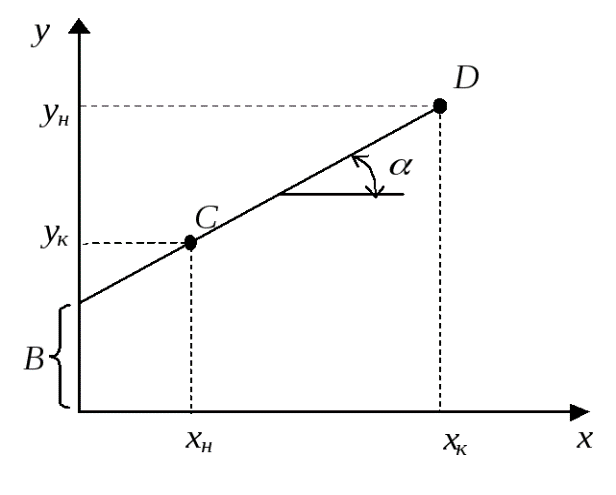 Выражения (XIV,1а) и (XIV,1б) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов.
Выражения (XIV,1а) и (XIV,1б) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов.
Таким образом, рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами 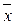 н и
н и 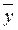 к (верхний конец аппарата, рис. XIV-2) и
к (верхний конец аппарата, рис. XIV-2) и 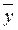 и и
и и 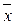 к (нижний конец аппарата).
к (нижний конец аппарата).
5. Движущая сила процесса массопередачи. Направление перехода вещества
Процесс М-П связан с переходом вещества из одной фазы в другую. Причиной, вызывающей переход, является различное содержание распределенного компонента в фазах. Процесс М-П состоит из 3х стадий: 1 перенос вещества в пределах одной фазы 2 переход вещества через границу раздела фаз 3 перенос вещества в пределах одной фазы. Раздел вещества внутри каждой фазы происходит путем диффузии. Поэтому процесс М-П называется диффузионным. ДСП: разность концентраций вещества (рабочая и равновесная в пределах каждой фазы). Если газовая фаза (G):Y-Y*(∆Y), если жидкая (L): X-X* (∆X). *-состояние равновесия. У,Х-рабочие концентрации. Часто процессы М-П обратимы и направление перехода вещества будет зависеть от Р,Т,С. ДСП характеризуется степенью отклонения системы от состояния динамического равновесия.








