Министерство сельского хозяйства Российской Федерации




Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Вятская государственная сельскохозяйственная академия»
ДНЕВНИК ПРАКТИКИ
(является неотъемлемой частью отчета)
| ФИО обучающегося | Макарова Татьяна Анатольевна |
Факультет ветеринарной медицины Курс ___6______
Форма обучения заочная______
Специальность 36.05.01 Ветеринария___________________________________
Направленность Ветеринария________________________________________
Вид практики: производственная_______________________________________
Тип практики: научно-исследовательская работа__________________________
_____________________________________________________________________
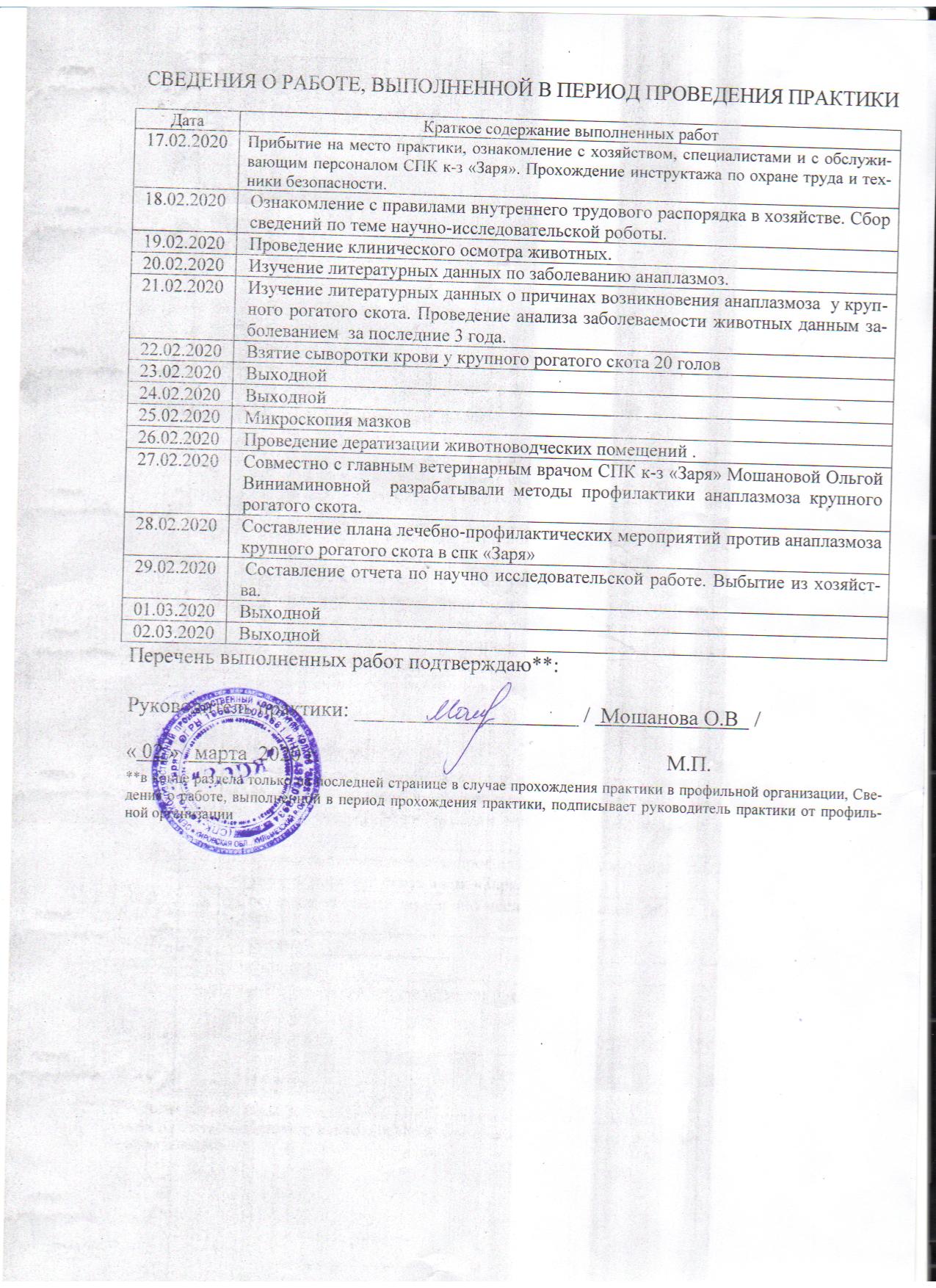
Сроки проведения практики: с 17 февраля 2020 г. по 02 марта 2020 г.
| Место проведения практики (профильная организация): | |||
| СПК к-з «Заря» | |||
| Кировская область, Кильмезский район | |||
| Руководитель практики от организации*: | |||
| доцент Кирилловых Анна Сергеевна | |||
| Руководитель практики от профильной организации: | |||
| Мошанова Ольга Виниаминовна | |||
Киров,2020
*Здесь и далее: организация - ФГБОУ ВО Вятская ГСХА



Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
в ысшего образования
«Вятская государственная сельскохозяйственная академия»
ФАКУЛЬТЕТ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ
Кафедра терапии, хирургии, акушерства и незаразных болезней
отчет по практике
| ФИО | Макарова Татьяна Анатольевна |
форма обучения: заочная
специальность: 36.05.01 Ветеринария
направленность программы: Ветеринария
курс 6, группа ВВз-610
Вид практики: Производственная
Тип практики: Научно –исследовательская работа
Период практики (по графику учебного процесса)
с « 17» февраля 2020 г. по « 2 » марта 2020 г.
Руководитель: _Кирилловых Анна Сергеевна
Регистрационный номер на кафедре___936____
Дата регистрации «_27_»_____июня___2020_г.
Результат проверки ___зачтено_____
Киров 2020
Оглавление
Введение. 11
1. Характеристика анаплазмоза. 12
1.1. Определение заболевания, морфология и биология возбудителя. 12
1.2 Экономический ущерб . 13
1.3 Эпизоотологические данные. 14
1.4..................................................................................................... Патогенез. 15
1.5. Клинические признаки. 16
1.6. Диагноз. 17
2 Профилактические мероприятий в хозяйстве 17
3. Анализ эпизоотической ситуации по анаплазмозу крупного рогатого скота в Кильмезском районе Кировской области. 20
4. Разработка мероприятий по совершенствованию профилактической и лечебной деятельности. 21
5.Профилактические мероприятия ,оптимальные методы лечения оптимальные методы диагностики………………………………………………………………………23
6.Заключение ……………………………………………………………………………………………………………………………………………………29
7.Приложения ……………………………………………………………………30
Введение.
Анаплазмоз наносит, большой экономический ущерб животноводству, который складывается из снижения мясомолочной продуктивности, качества и количества продуктов животного происхождения, ущерба от недополучения молодняка и гибели животных. По данным отечественной и зарубежной литературы, возбудители анаплазмозов животных имеют близкое генетическое родство с возбудителями анаплазмозов и эрлихиозов человека и относятся к одному и тому же семейству Anaplasmatacea. Возбудителями анаплазмозов у людей и животных генетически не идентифицированы в России, не доказано генетическое родство и отличие между ними, однако считается что один из них - A. phagocytophila является возбудителем гранулоцитарного анаплазмоза как у животных, так и у человека. Исходя из этого, можно предположить, что одними и теми же или очень близкими анаплазмозами болеют люди и животные. Значит, больные люди и животные могут представлять эпидемическую и эпизоотическую опасность. [ 13]
Цель научно исследовательской работы: диагностика анаплазмоза крупного рогатого скота в СПК к-за «Заря» Кильмезского района Кировской области и разработка мероприятий по профилактике.
1. Характеристика анаплазмоза
1.1. Определение заболевания, морфология и биология возбудителя
Анаплазмоз жвачных животных – трансмиссивная кровепаразитарная болезнь крупного и мелкого рогатого скота вызываемая кровепаразитами из рода анаплазм, протекающая с симптомами общего угнетения, анемии, атонии желудочно-кишечного тракта, лихорадкой непостоянного типа и истощением. Из домашних животных анаплазмозом болеют крупный рогатый скот, буйволы, зебу, овцы, козы. Обычно анаплазмоз регистрируется в местах распространения пироплазмоза, бабезиоза, тейлериоза, нередко в виде смешанной инвазии.
Возбудитель анаплазмоза крупного рогатого скота – Anaplasma marginale, у мелкого рогатого скота – Anaplasma ovis. Возбудитель. По своим морфологическим признакам анаплазмы близки к риккетсиям. Анаплазмы имеют одноконтурную плазматическую мембрану, клеточную стенку, нуклеоид, тяжи, фибриллы и мембранные структуры в цитоплазме. Возбудители анаплазмоза локализуются в эритроцитах, иногда анаплазм находят в лейкоцитах и тромбоцитах, где они формируют колонии, состоящие из 2-8 особей. При микроскопии мазков крови окрашенных по Романовскому анаплазмы имеют вид фиолетово-синеватых или рубиновых округлых включений величиной 0,1-1,25µ, реже встречаются анаплазмы угловатой или вытянутой форме с отростками (последние бледнее окрашены). Принято считать, что анаплазмы располагаются ближе к краю эритроцита. В эритроците встречаются по 1-2 и реже 3-4 паразита, иногда больше[3]
Рисунок1. Анаплазмы в эритроцитах.

Цикл развития. Размножаются анаплазмы в эритроцитах методом простого деления или почкования, в результате чего образуют колонии. При электронной микроскопии в анаплазмах выявлены так называемые инициальные тельца, которые состоят из микроколоний. Поражение здоровых эритроцитов при анаплазмозе происходит в результате проникновения в них инициальных телец. Биологическими переносчиками анаплазм у животных являются 11 видов иксодовых клещей и один вид аргасовых (Alveonasus lahorensis). Во время кровососания больных анаплазмозом животных анаплазмы попадают в кишечник клещей, где размножаются. Передача возбудителей клещами происходит трансовариально и трансфазно. Механическими переносчиками анаплазм являются кровососущие насекомые. У овец перезаражение анаплазмозом может быть при паразитировании кошарного клеща, овечьей кровососки, кровососущих двухкрылых насекомых – мух, слепней, комаров и др. При несоблюдении существующих правил асептики и антисептики ветеринарные специалисты во время ветеринарных обработок (взятие крови, вакцинация, обрезка рогов и т.д.) с нестерильными инструментами могут переносить анаплазмоз от одного животного другому.[3]
1.2 Экономический ущерб .
Анаплазмоз крупного рогатого скота наносит большой ущерб животноводству. Он резко снижают продуктивность животных. уменьшается молокоотделение. При анаплазмозе падеж крупного рогатого скота может достигать 40%, обостряется течение некоторых инфекционных хронических болезней (анаплазмоз + инфекционная анемия). Так, же анаплазмоз отрицательно влияет на репродуктивную способность и резистентность организма животных. У переболевших животных (до 80%) в течение длительного времени наблюдаются сердечная недостаточность, нарушения деятельности других органов, низкая продуктивность и работоспособность.[4]
1.3 Эпизоотологические данные.
Возбудителей анаплазмоза переносят иксодовые клещи 11 видов и один вид аргасовых, а также слепни, комары, мошки, мокрецы, мухи-жигалки и др. Передача анаплазм происходит трансфазно и трансовариально. Кровососущие насекомые могут переносить анаплазм от одних животных к другим в процессе питания кровью, однако в их организме они не размножаются, поэтому насекомых считают механическими переносчиками. Анаплазмоз регистрируют весной, летом и осенью, р редких случаях болезнь встречается в зимнее время, особенно при плохом кормлении, в условиях минеральной и витаминной недостаточности.
В Кировской области бабезиоз КРС впервые был зарегистрирован в 2006 г. в Верхошижемском районе в ОАО «Агрофирма Среднеивкино». Заболели три коровы с летальным исходом. В 2008 г. в Советском районе (СПК СА«Мушинский») заболели 5 коров, из них три животныхс летальным исходом, а в 2009 г. в ОАО «Мокинское»выявлено три случая бабезиоза. В 2010 г. число заболевших бабезиозом животных в Советском районе выросло в 3 раза (в СХПК «Лошкаринский» заболело 6 голов, в частном секторе д. Кочки — 3 коровы), а в 2012 г. — в 1,3 раза по сравнению с 2010 г. (заболело с летальным исходом 12 коров в Кирово-Чепецком районе (ООО «Аг-рофирма «Фатеево») и в Богородском районе (колхоз«Чирковский») Кировской области) [4, 5]. В 2013 г. бабезиоз был обнаружен в Верхошижемском районе в СХПК «Звезда» у двух коров, одна из которых, принадлежала частным владельцам, но выпасалась вместе со стадом хозяйства. Оба случая с летальным исходом [4].При микроскопии мазков из крови КРС в эритроцитах были обнаружены преимущественно парной грушевидной формы паразиты, соединенные тонкими концами под острым углом, что является характерным диагностическим признаком паразита Bаbеsiа bigemina (Рiroplasma bigeminum). Длина парных грушевидных форм была больше радиуса эритроцита, расположение в эритроците — в центре (рис. 1). Число паразитов в одном эритроците от одного до четырех. Размер парных грушевидных 2...3 мкм. Анаплазмоз КРС регистрируется в Кировской области 2005 г. [3]. В ходе исследований в категорию стационарно неблагополучных по анаплазмозу были отнесены три южных района области — Вятско-Полянский, Малмыжский, Кильмезский. Средний процент зараженности составил 80,56 % [5].[12]
1.4 Патогенез.
Попадая в организм восприимчивых животных, анаплазмы вызывают нарушение окислительно-восстановительных и обменных процессов. Для своего развития они используют фосфолипиды эритроцитов, уменьшение содержания фосфолипидов приводит к осмотической хрупкости последних. Сокращается продолжительность жизни эритроцитов, усиливается эритрофагоцитоз. В активности последнего важную роль играют аутоантитела, образующиеся против антигенно-измененных эритроцитов. Нарушается гемопоэз. Уменьшается содержание эритроцитов и гемоглобина в крови, что приводит к нарушению кислородного питания клеток и тканей. Развивается анемия. Гемоглобинурия бывает редко. В крови снижается содержание общего белка и альбуминов. После пика паразитемии ускоряется разрушение эритроцитов и прогрессирует анемия. В кровь поступает много незрелых и измененных эритроцитов (анизо- и пойкилоцитоз, ретикулоцитоз, эритробластоз). Нарушение обмена веществ ведет к интоксикации организма, воспалительным процессам, кровоизлияниям в органах и тканях. Развиваются сердечно-сосудистый и желудочно-кишечный синдромы.[8]
1.5. Клинические признаки.
Клиническая картина. Инкубационный период при естественном заражении от 3до 6 недель, реже до 3 месяцев. Болезнь может протекать остро и хронически.
Острое течение болезни у животного начинается с повышения температуры тела до 41°С и больше. Лихорадка имеет непостоянный тип. У животного ухудшается общее состояние, понижается аппетит. Появляется основной признак анаплазмоза – резко выраженная анемия. При исследовании крови отмечаем уменьшение содержания гемоглобина в 4-5раз, количества эритроцитов доходит до1млн. в 1мм³, уменьшается и показатель гематокрита. В крови отмечаем анизоцитоз, пойкилоцитоз, наличие ядерных эритроцитов и их базофильную зернистость. В начале болезни у больного животного находим лейкоцитоз, переходящий в лейкопению, при выздоровлении животного отмечаем лимфоцитоз. В сыворотке крови снижается содержание витамина. В результате нарушения минерального обмена, больные животные лижут или грызут стены, землю. Видимые слизистые оболочки бледные, могут быть желтушными. Поверхностные лимфатические узлы при пальпации увеличенные. Деятельность сердечно – сосудистой и дыхательной систем, в связи с развившейся у животного анемией, нарушается. В области шеи, подгрудка и живота могут появиться отеки. У больного животного развивается атония преджелудков, у коров снижаются удои. Больные животные резко худеют и слабеют, больше лежат. В моче находим много индикана, иногда ацетоновые тела. Количество эритроцитов иногда снижается до 1млн. в 1 мм³. Во второй половине беременности у животных наступает аборт. Острое течение болезни длится 15- 30 суток. При выздоровлении животного имеющиеся признаки болезни постепенно исчезают, однако упитанность животного восстанавливается медленно.
Хроническое течение анаплазмоза у животного сопровождается перемежающей лихорадкой. Такие животные плохо принимают корм, при перегонах быстро устают, не набирают массу тела даже при хорошем кормлении. При клиническом осмотре отмечаем атонию и гипотонию преджелудков. При исследовании крови регистрируем уменьшение числа эритроцитов, снижается содержание гемоглобина. В результате чего видимые слизистые оболочки бледные. Отмечаем базофильную зернистость, что для ветеринарного специалиста является благоприятным прогностическим признаком и больное животное постепенно выздоравливает.[8]
1.6. Диагноз.
Диагноз на анаплазмоз ставят на основании эпизоотического состояния местности, сезона года, клинических признаков болезни и результатов микроскопического исследования мазков крови по Романовскому на наличие анаплазм.
2. Профилактические мероприятия в хозяйстве
Диагностические исследования крови коров 75% поголовья.
Приготовление мазков крови. Лучше мазки готовить из свежей, нативной крови. Из цитратной и оксалатной крови мазки можно приготовить до 6 ч после взятия ее, а из гепаринизированной — до 24 ч. Мазки крови готовят на предметных стеклах, которые нужно соответствующим образом подготовить.
Подготовка предметных стекол. Не бывшие в употреблении стекла промывают в водопроводной воде, а затем в дистиллированной, высушивают и закладывают в банку с притертой крышкой в смесь равных количеств этилового эфира и этилового спирта. Перед работой стекла извлекают пинцетом, протирают. При необходимости, подготовленные таким образом стекла складывают в пакеты, завертывают в бумагу и закладывают на хранение в полиэтиленовые мешочки, которые хорошо завязывают.
Техника приготовления мазков. Предметное стекло берут между большим и указательным пальцами левой руки. Отступя на 1 см от края стекла, лежащего ближе к указательному пальцу, наносят небольшую (диаметром 2 — 3 мм) каплю крови. Это делают обычно путем прикосновения поверхностью предметного стекла к капле крови на месте ее появления после прокола кожи. При изготовлении мазков из крови, взятой в пробирки, каплю ее наносят с помощью глазной или пастеровской пипетки или краем пробки. Затем правой рукой устанавливают вблизи от капли крови шлифованное стекло под углом 30 — 45° и осторожно продвигают его до соприкосновения края стекла с каплей крови. После этого, плавно и не очень быстро, продвигая, справа, налево шлифованное стекло по предметному, приготовляют мазок.
Мазок должен начинаться на 1 — 1,5 см от края предметного стекла и заканчиваться в 1 — 3 см от другого его края, составляя примерно 2/3 — 3/4 длины стекла. Мазок должен быть уже предметного стекла, с боков на стекле должны оставаться свободные поля шириной около 1 см. Хороший мазок не имеет перерывов, пустот, на всем протяжении одинаковый по толщине. Хорошие мазки получаются при подогревании предметных стекол на резиновой грелке с теплой водой 45 — 50 °С, или на электрообогревательном столике к микроскопу, или на стерилизаторе с горячей водой, закрытом крышкой; рекомендуется на этих же приспособлениях высушивать изготовленные мазки.
В холодное время необходимо предупреждать конденсацию паров воды на мазках крови, что может вызвать ее гемолиз.
На высушенном мазке в начальной его части простым карандашом или иглой от шприца пишут номер животного (или порядковый номер записи исследуемых животных) и дату взятия крови.
Фиксация мазков. Мазки крови необходимо в течение 2 дней после изготовления или зафиксировать, или окрасить. Нефиксированные мазки через месяц теряют способность правильно окрашиваться.
Для фиксации мазки погружают в метиловый спирт (5 мин), этиловый спирт (30 мин), этиловый спирт и этиловый эфир поровну (30 мин) или денатурированный спирт (30 мин). Мазки помещают в кюветы с фиксатором и закрывают крышкой. Мазки не должны соприкасаться. После фиксации мазки высушивают на воздухе.








