Эталоны решения задач
Задача 1.Рассчитайте ЭДС и напишите схему гальванического элемента, в котором обратимо протекает реакция по уравнению:
2Fe3++ HAsO2+2H2O=2Fe2++H3AsO4+2H+
При 1атм и 298К. Активности ионов участвующих в реакциях;
aFe²⁺=0,005 aFeᶾ⁺=0,02 aH3AsO2=0,1 aH2O=1
Решение.
Определим уравнения электродных реакций. Для этого из уравнения реакций, приведенной в условии, вычитаем уравнения одной из прилагаемых электродных:
2Fe3++ HAsO2+2H2O=2Fe2++H3AsO4+2H+
2Fe3++2ē=2Fe2+
H3AsO4+ 2H⁺+2ē= HAsO2+2H2O
В справочнике находим соответствующие стандартные электродные потенциалы:
e1º=e H3AsO4, 2H⁺, HAsO2 =0,560В;
е2=еº Fe3+, Fe2+=0,771В.
Вычисляем электродные потенциалы по уравнению:
e1=eºH3AsO4, 2H⁺, HAsO2+ 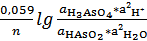 ; n=2
; n=2
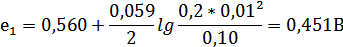
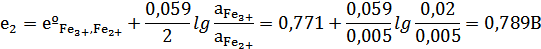
Подставляем полученные значения е1и е2 в уравнение:
Е=е2-е1
Е=0,789-0,451=0,338В.
Схема элемента
Pt/H+, H3AsO2, HAsO2//Fe3+,Fe2+, H2O/Pt
Задача 2.Определитьконстантуравновесияреакций:
KMnO4+5FeCl2+8HCl=MnCl2+KCl+5FeCl3+4H2O
Если нормальный потенциал Fe2+/Fe3+, равен 0,77В, а MnO4-+8Н+=5ē→Mn2++4H2O=1,52
Решение
Написав уравнение реакции в ионной форме,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
Находим константу равновесия:
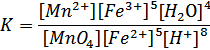
В состоянии равновесия потенциалы Fe2+→Fe3+ и MnO4+8H++5ē→Mn2++4H2O
Должны быть равны:
Еº 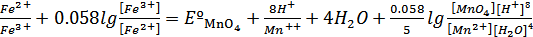
В этой реакции окислителем является MnO4-, а восстановителем Fe2+. Число электронов, отдаваемых восстановителем и принимаемых окислителем, равно 5:
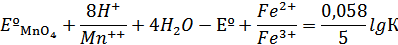
Логарифм константы равновесия рассматриваемой реакции равен:
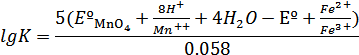
Подставив в эту формулу значения нормальных окислительно – восстановительных потенциалов, получим:
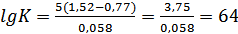 Отсюда, К=1064
Отсюда, К=1064
Задача 3. ЭДС цепи, составленной из насыщенного каломельногои водородного электродов, заполненного желудочным соком, при температуре 18ºС равна 0,332В. Потенциал насыщенного каломельного электрода по нормальному водородному при 18ºС равен Е=0,250В. Найти рН желудочного сока
Решение
Определяем ЭДС по отношению к нормальному водородному электроду: 0,332-0,250=0,082В.
Применив уравнение 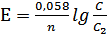 , приняв n=1 и С=1, находим:
, приняв n=1 и С=1, находим:
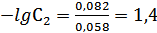 , но –lgC2=рН=1.4
, но –lgC2=рН=1.4
ТЕСТОВЫЙ САМОКОНТРОЛЬ
Потенциал какого из перечисленных электродов не зависит от рН
A: каломельного
B: водородного
C: стеклянного
D: хингидронного
Какой из электродов наиболее часто используют для определения рН
A: стеклянный
B: цинковый
C: хлорсеребряный
D: хингидронный
К какому типу электродов относится хлорсеребряный электрод:
A: II рода
B: I рода
C: окс-восст
D: ион-селективный
E: газовый
Какое титрование можно проводить с помощью гальванического элемента:
Ag/AgCl/HCl/стекл. мембрана/иссл. р-р/KCl/AgCl/Ag
A: кислотно-основное
B: осадительное
C: оксислительное-восстановвительное
D: комплексонометрия
E: амперометрия
Какую из приведенных цепей предпочтительнее использовать для определения концентрации лекарственного вещества, обладающего кислотно-основными свойствами:
A: Ag/AgCl/HCl/стекл. мембрана/иссл. р-р/KCl/AgCl/Ag
B: Pt/H2/иссл. р-р/KCl/AgCl/Ag
C: Pt/H2/иссл. р-р/KCl/Hg2Cl2/Hg
D: Pt/C6H4(OH)2, C6H4O2/иссл. р-р/KCl/AgCl/Ag
E: Ag /AgCl /KCl / иссл. р-р/KCl/AgCl/Ag
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Физическая химия. В 2 кн. / Под ред. К. С. Краснова:-3-е изд., испр. -- М.: Высш. школа, 2001.
2. Стромберг А. Г., Семченко Д. П. Физическая химия. – 4-е изд., испр. - М.: Высш. школа, 2001. – 527с.
3. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. – М.: Высшая школа, 1990.
4. Калібабчук В.О., Грищенко Л.І., Галинська В.І. Медична хімія. – К.: Інтермед, 2006.
5. Красовский И.В., Вайль Е.И., Безуглий В.Д. Физическая и коллоидная химия. – К.: Вища школа, 1983.
6. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М.: Высшая школа, 1989.
7. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Світ, 2006.
8. Мороз А.С., Ковальова А.Г., Фізична та колоїдна хімія. – Львів: Світ, 1994.
9. Миронович Л.М., Мардашко О.О. Медична хімія. – К.: Каравела, 2007.
10.Физическая и коллоидная химия. Под ред. проф. Кабачного В.И. – Харьков: Изд-во НФАУ, 2001.
11.Физическая химия. Под ред. Краснова К.С. – М.: Высшая школа, 1982.
12.Филиппов Ю.В., Попович М.П. Физическая химия. – М.: Моск. уи-т, 1980.
13. Садовничая Л.П. Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. – К.: Вища школа, 1986.
Рецензенты: зав кафедрой органической химии
д. фарм. н., Коваленко C.И.
проф. кафедры биологической химии ЗГМУ
д. фарм. н., Романенко Н.И.
Методическое пособие подготовили сотрудники кафедры физической и коллоидной химии Запорожского государственного медицинского университета:
- д. фарм. н., Каплаушенко А.Г.;
- доц. Похмёлкина С.А.;
- доц. Чернега Г.В.;
- доц. Пряхин О.Р.;
- ст. пр. Авраменко А.И.;
- асс. Юрченко И.А.;
- ст. лаб. Щербак М.А.;
Рассмотрено и утверждено на заседании цикловой методической комиссии химических дисциплин Запорожского государственного медицинского университета (протокол №______ от_______ 2015 года)
Копирование и тиражирование только по письменному согласию ЗГМУ








