Потенциометрическое титрование.
В объемном титриметрическом анализе для определения точки эквивалентности часто пользуются методом потенциометрического титрования. Для этого измеряют изменение потенциала индикаторного электрода, обратимого по отношению к ионам титруемого вещества, или титранта. Этот потенциал вблизи точки эквивалентности резко изменяется от добавления небольшого количества реагента. Для наглядного изображения хода титрования и более точного нахождения точки эквивалентности строят кривую титрования, наносят на ось ординат значения э.д.с. гальванической цепи, используемой для титрования, на ось абсцисс – объем титранта в миллилитрах.
Потенциометрическое титрование применяется в методах осаждения с комплексообразованием, оксидиметрии и, особенно широко, -при кислотно-основном титровании. В этом случае в качестве индикаторного электрода используют хингидронный, сурьмяный или стеклянный, электроды сравнения-каломельный или хлорсеребряный.
Практически потенциометрическое титрование осуществляется следующим образом: в известный объем анализуемого вещества помещают электроды, которые подключают к pH-метру; к этому объему раствора небольшими порциями при постоянном перемешивании прибавляют раствор титранта и каждый раз измеряют э.д.с. элемента.
В начале титрования, когда концентрация исследуемого вещества велика, добавление титранта вызывает незначительное изменение потенциала индикаторного электрода и э.д.с. В момент эквивалентности скачок потенциала резко возрастает, а затем, при избытке титранта, снова плавно изменяется.
Преимущество потенциометрического титрования по сравнению с индикаторным состоит в том, что метод можно применять для анализа окрашенных и мутных растворов, многокомпонентных систем, многоосновных кислот и многокислотных оснований.
Потенциометрическое титрование широко используется также для оценки относительных констант диссоциации слабых электролитов и аминокислот. При определенных навыках этим методом можно определять кислотные и основные группы белков.
вопросы для самоподготовки
1.Что понимают под потенциометрией?
2.Какие вы знаете электроды сравнения и электроды определения?
3.Что такое гальванический элемент?
4.Чем характеризуются электроды первого рода? Привести пример.
5.В чем особенности электродов второго рода?
6.Как устроен каломельный электрод?
7.Привести примеры окислительно-восстановительных электродов.
8.Какие электроды используются для определения рН ?
9.Что такое окислительно -восстановительная система?
10.В чем состоит отличительная особенность измерения окислительно-восстановительного потенциала?
11.Какие задачи можно решить, изучая метод потенциометрического титрования?
12. В чем состоит принцип потенциометрического титрования?
13. Какая химическая реакция лежит в основе определения рН методом потенциометрического титрования?
14. Объяснить ход кривой потенциометрического титрования по реакциям нейтрализации.
15. Как определить эквивалентный объем титрования и концентрацию исследуемого раствора.
16. В чем состоит значение метода потенциометрического титрования в исследованиях в биологии медицине и фармации.
Экспериментальные работы
Работа 1. Изменение электродных потенциалов и ЭДС гальванических элементов
Методика эксперимента.
1. Включить иономер в сеть для прогревания в течении 5 – 10 минут.
2. Налить в сосуд растворы 0.1 н солей CuSO4 и ZnSO4, соединить их электролитическим мостиком и погрузить в растворы электрод из соответствующих металлов.
3. Определить по таблице стандартных электродных потенциалов знаки полярности металлов и подключить их к соответствующим клеммам иономера.
4. Измерить ЭДС собранного гальванического элемента по шкале прибора.
5. Измерить электродный потенциал Zn. Для этого собрать гальванический элемент из измеряемого электрода цинка в растворе 0,1н ZnSO4 и стандартного хлорсеребряного электрода, погруженного в KCl. Сосуды соединить электролитическим мостиком. Какова полярность электродов?
6. Аналогичным способом определить электродный потенциал меди.
7. Измерить рH исследуемого раствора. Для этого собрать гальванический элемент из хлорсеребряного электрода сравнения и хингидронного электрода определения, который можно легко приготовить самостоятельно (взять указанный преподавателем раствор HCl, СH3COOH, либо другие, содержащий ионы водорода, насыпать в него щепотку хингидрона, размешать и погрузить платиновый электрод). Измерить ЭДС такого гальванического элемента. Найти значения потенциала хингидронного электрода. Используя уравнения Нернста, рассчитать рН раствора.
Отчёт по работе должен содержать:
1. Экспериментальные результаты.
2. Рассчитываемые значения теоритических значений электродных потенциалов и ЭДС в растворах 1н солей.
3. Сравнить измеренные величины с теоретическими. Вычислить значения абсолютной и относительной погрешностей.
4. Значение рН расследуемого раствора.
5. Зарисовать схемы электродов: каломельного, хингидронного, водородного.
Работа 2. Определение концентрации кислоты методом потенциометрического титрования
Методика эксперимента.
1. Концентрацию раствора определяют при помощи рН – метра. Для этого включить прибор в сеть для прогревания (10 – 15 минут).
2. В бюретку залить 0,1н раствора щелочи NaOH. Отобрать пипеткой в стаканчик 10мл задачи (№ задачи даёт преподаватель).
3. Стаканчик установить на столик датчика, чтобы электроды были погружены в исследуемый раствор и не касались стенок стаканчика.
4. Приливать раствор щелочи из бюретки в стаканчик порциями: по 2 мл до рН равный 2 – 3, далее по 0,5мл до резкого скачка потенциала (до рН=7 - 8), а затем снова по 2 мл до рН= 12 – 13.
5. После каждого приливания щёлочи тщательно перемешивать раствор в стаканчики стеклянной палочкой и, выдержав 1 минуту, снять показания прибора по нижней шкале (2 - 15). Для точности проводить 2 титрования.
6. Полученные данные заносить в таблицу:
| Количество кислоты | Количество щелочи | рН | Концентрация | рН | |
| К - ты | Щелочи | ||||
1) По полученным данным построить график зависимости рН от количества добавляемой щелочи рН = f(v) и дифференциальную зависимость
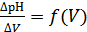 .
.
2) По графику определить эквивалентную точку и объем щелочи, из расходованный на титрование.
3) Сделать выводы по работе.
Работа 3.Потенциометрическое титрование окислительно – восстановительных систем
Методика эксперимента.
1. Включить прибор в сеть для прогревания в течении 5 – 10 минут.
2. В бюретку залить 0,1м раствор перманганата калия.
3. В стаканчик для титрования налить:
· Задание 1. 5мл раствора восстановителя Fe²⁺ (0,1М), 7,5мл раствора серной кислоты
Смесь тщательно перемешать.
· Задание 2. 2,5мл 0,1н раствора йодида калия, 5мл раствора насыщенного йодида калия и 7,5мл 2н раствора соляной кислоты.
Смесь тщательно перемешать.
4. Стаканчик с исследуемым раствором поместить на столик магнитной мешалки, ввести электрод (платиновый и хлорсеребряный) и при непрерывном помешивании титровать раствором окислителя – перманганата калия.
Добавление перманганата калия производят по 0,5 мл.
Количество добавленного реагента должно в 2 раза превышать количество исследуемого раствора. Полученные данные ЭДС (после каждого добавления) заносят в таблицу:
| Количество исследуемого раствора | Титрант | Е, мВ | Концентрация исследуемого раствора | |
| Концентр. | Объем | |||
5. По данным таблицы построить график Е=f(v) и определить окислительно – восстановительный потенциал исследуемого раствора, а так же его эквивалентную концентрацию.
6. Объяснить наличие перегибов на кривых титрования согласно реакциям (потенциалы даны относительно Ag (AgCl (Cl)):
Fe²⁺=Feᶾ⁺ E=0,551В
MnO2+4H⁺+ 2ē=Mn²⁺+2H2О; Е≠1,00В
Отчёт по работе должен содержать:
1.Таблицу по экспериментальным данным.
2.График зависимости Е= f(v).
3.Выводы по работе.
Работа 4.Ионометрическое определение ионов натрия и фторид – ионов в растворах
Методика эксперимента.
1. Проводим подготовку, включение и настройку измерительного прибора согласно прилагаемой к нему инструкции (выполняет преподаватель). В стаканчик наливают раствор 0,1М NaCl, погружают в него электрод и измеряют ЭДС элемента. Готовят 0,01М раствор NaCl: берут 0,1М NaCl, добавляют 9мл дистиллированной воды. Измеряют ЭДС. Готовят 0,001М раствор аналогично предыдущему, в качестве исходного раствора берется 0,01М раствор. Измеряют ЭДС.
Аналогичные измерения проводят в 10⁻4 и 10-5 концентрациях раствора NaCl.
Результаты измерения записывают в таблицу:
| № раствора | р Na | ЭДС(мВ) |
Строят калибровочный график в координатах ЭДС - рNa и находят область прямолинейной зависимости.
Определяют угловой коэффициент наклона и сравнивают его с теоретическим значением (56±3мВ).
Определяют концентрацию ионов Na в контрольном растворе, используя метод калибровочного графика.
2. Раствор для градуировки концентрации до 10-6М готовят из 0,001М NaF, дважды перекристализованного и прокаленного до 400ºС . Буферный 0,2М раствор цитрата натрия в 20% этаноле готовят растворение рассчитанной навески цитрата натрия в воде с последующим прибавлением 12,4мл HCl(концентр.), 200мл 96% этанола при доведении объема раствора до 1л рН раствора 5,4 – 5,6.
Термостатируютячейку при 25ºС, содержащую 10мл стандартного раствора NaF, смешанного с 10мл буферного раствора. Измеряют потенциал фторид – селективного электрода относительно хлорсеребрянного электрода сравнения.
Полученные результаты заносят в таблицу:
| № раствора | р F | ЭДС (мВ) |
Построить график зависимости Е=f(pF).
Определить содержание Сf-в растворе по градуировочному графику.
ЗАДАЧИ
1. Вычислить ЭДС концентрационного элемента при 298К Ag/0.05н. AgNO3//насыщ. KCl//2н AgNO3/Ag.
16. ЭДС цепи, составленной из насыщенного каломельного электрода и водородного электрода, заполненного исследуемым раствором при 298К равна 0,562В. Потенциал насыщенного каломельного электрода относительно водородного электрода равен 0,242В. Вычислить рН раствора.
2. Вычислить нормальный потенциал Cl2, если ЭДС цепи: (Pt)Cl2/0.05 и HCl//Hg2Cl2/Hgв 1 н KClпри 298К равны 1,157В, кажущаяся степень диссоциации 0,05н раствора НCl равна 0,87. Величина нормального каломельного электрода с 1н раствором KClравна 0,281В.
3. ЭДС цепи, составленной из водородного электрода и хингидронного электрода, заполненного исследуемым раствором, при 298К равна 0,544В. Определить рН исследуемого раствора. Потенциал хингидронного электрода при 298К равен: Ехинг.=0,6990-0,059рН.
4. ЭДС цепи, составленной из насыщенного каломельного электрода и хингидронного электрода, заполненного исследуемым раствором, при 298К, равна 0,274В. Найти рН исследуемого раствора.
5. Вычислить ЭДС цепи, составленнойиз насыщенного каломельного электрода и хингидронного электрода, заполненного 0,001н раствором HClпри 298К, считая HCl полностью диссоциированной.








