Теоретический материал по теме
Электродные потенциалы и ЭДС.
Потенциометрией называют совокупность методов исследования и определения различного рода величин, основанных на измерении электродвижущих сил гальванических элементов.
Величина ЭДС (ЕГ.Э.) гальванического элемента может быть определена как разность электродных потенциалов. Гальванический элемент всегда записывают таким образом, чтобы на левом электроде шел процесс окисления, а на правом восстановления и ЕГ.Э = е+2 – е –1.
Измерив ЕГ.Э и зная потенциал одного из электродов (электрода сравнения) можно определить потенциал электрода определения.
В медицинской практике большое значение имеет потенциометрический метод измерения кислотности биологических средств (рН), определение ох/red потенциалов, потенциометрическое кислотно-основное и ох/red титрование
Значение потенциометрических методов исследования для медиков огромно. Изучение закономерностей возникновения электродных и окислительно-восстановительных потенциалов и их зависимости от различных факторов в простейших физико-химических системах позволяет понять закономерности многих сложных биохимических процессов, протекающих в организме, в частности процессов биологического окисления. Перенос электронов и протонов с окисляемого субстрата на кислород осуществляется при помощи определенного ряда промежуточных ферментов - переносчиков. Каждое звено этой цепи соответствует той или иной редокс-системе, характеризующейся определенным окислительно-восстановительным потенциалом.
Измерение биопотенциалов лежит в основе таких ценных диагностических методов, как электрокардиография, электроэнцефалография и др.
С другой стороны, потенциометрия - незаменимый во многих случаях метод определения концентрации физиологически активных ионов (К+, Nа+, Са2+, NН4+, Сl-, и др.), определение кислотности в биологических жидкостях (крови, спинномозговой жидкости и др.) и тканях организма. Миниатюрные ионселективные электроды позволяют проводить исследования на клеточном уровне.
Косвенные потенциометрические методы (потенциометрическое титрование) используются для определения концентрации биологически активных и лекарственных веществ в биологических объектах.
Потенциал, возникающий на границе раздела металл-раствор соли этого металла, называют электродным. Его величина определяется уравнением Нернста:
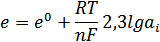
где: e0 – стандартный потенциал электродной реакции (при температуре Т=298К и активности иона металла а = 1),
n – число электронов, принимающих участие в реакции,
R – универсальная газовая постоянная,
F – постоянная Фарадея;
аі - активность иона.
В том случае, если инертный металл (например, платина) опущен в раствор, содержащий окисленную и восстановленную форму одного или нескольких веществ, на границе раздела фаз возникает потенциал, который называют окислительно-восстановительным или редокс-потенциалом. Его величина определяется соотношением активностей окисленной а (ох) и восстановленной а(red) форм (уравнение Петерса):
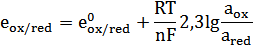
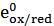 - стандартный редокс-потенциал,
- стандартный редокс-потенциал,
В том случае, если границей раздела фаз служит мембрана, способная избирательно обменивать входящие в ее состав ионы с электролитом, возникающий потенциал принято называть мембранным, например, стеклянный электрод.
Потенциалы измеряют в Вольтах, В.
Классификация электродов.
Электродом первого рода называют металл или неметалл, опущенный в раствор, содержащий его ионы. Электрод первого рода можно представить в виде схемы: Мe n+ | Me
Уравнение реакции: Мen+ + ne- = Me
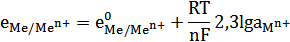
Разновидностью электродов первого рода являются газовые электроды. Это инертный металл (платина или палладий), насыщенный газом и опущенный в раствор, который содержит ионы этого газа. Одним из представителей этих электродов является водородный электрод.
Водородный электрод: Pt | H2 | H+ р-р.
Потенциал возникает в результате реакции: 2H+ + е- = H2 .
Уравнение Нернста для него:
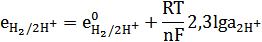
Водородный электрод, который работает в условиях 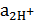 = 1 моль/л,
= 1 моль/л, 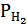 = 101,25 кПа. Т = 298 К называется стандартным. Потенциал стандартного водородного электрода е0 принято считать равным «0».
= 101,25 кПа. Т = 298 К называется стандартным. Потенциал стандартного водородного электрода е0 принято считать равным «0».
Стандартный водородный электрод используется как электрод сравнения. В случае, если водородный электрод работает не в стандартных условиях, его потенциал зависит от концентрации ионов водорода, а следовательно рН среды. Уравнение Нернста будет таким:
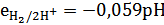
Такой электрод используется как электрод определения (индикаторный электрод).
К электродам второго рода относятся электроды, состоящие из металла, покрытой труднорастворимой солью этого металла, погруженного в раствор соли с одинаковым анионом. К ним относятся:
1. Хлорсеребряный электрод Ag | AgCl | KCl
При работе электрода происходит реакция:
AgCl + e-= Ag + Cl-
Активность металлического серебра и AgCl можно считать постоянной, поэтому потенциал хлорсеребрянного электрода будет зависеть только от активности ионов хлора. Благодаря этому электродный потенциал является постоянным, а электрод используется в качестве электрода сравнения.
Величина потенциала описывается уравнением Нернста:
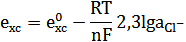
Благодаря такому устройству потенциал этого электрода остается постоянным и используется как электрод сравнения.
Для насыщенного раствора калий хлорида при Т=298К е=0,222В
2. Каломельный электрод Нg, Hg2Cl2 | KCl работает аналогично хлорсеребряному.
Hg2 Cl2 + 2e- = 2Hg + 2Cl-.
Величина потенциала описывается уравнением Нернста:
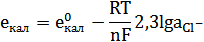
Механизм возникновения потенциала данного электрода является аналогичным хлорсеребряному и также используется как электрод сравнения. Потенциал данного электрода в насыщенном растворе калий хлорида и Т=298 К постоянно равен 0,248В и используется как электрод сравнения.
Окислительно-восстановительные (окс-ред) электроды представляют собой инертные металлы, опущенные в раствор, содержащий окисленную и восстановленную форму одного и того же вещества.
В растворе между окисленной и восстановленнной формой ионов идет ОВР и возникает потенциал Fe3++e- = Fe2+, Sn4++2e- = Sn2+
Инертный металл участия в реакции не принимает, а является переносчиком электронов.
Например:
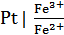 ,
, 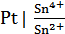
Потенциалтакого электрода описывается уравнением Петерса
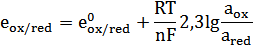
К окислительно-восстановительным электродам относится хингидронный электрод, в котором окислительно-восстановительная реакция между хиноном и гидрохиноном в кислой среде:
C6H4O2+2H++2e- = C6H4(OH)2
хинон гидрохинон
Pt | хингиндрон, H3O+
Для него уравнением Петерса: 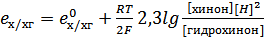
Для растворов с рН<8 можно принять ахин.= ахг. Тогда уравнение для его потенциала будет следующее:
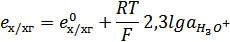
Т.к. 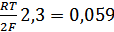 , а
, а 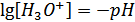 , уравнение принимает вид:
, уравнение принимает вид:
при T=298K 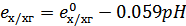
Поскольку потенциал хингидронного электрода зависит от рН раствора, электрод используется как индикаторный.
Представления об окислительно-восстановительных потенциалах необходимы при изучении окислительно-восстановительных процессов в организме.
Биологическое окисление является основным источником энергии в организме и имеет многоступенчатый характер. В настоящее время удалось с достаточной полнотой выяснить природу многих окислительно-восстановительных систем и ферментов, принимающих участие в биологическом окислении, хотя механизм их действия еще до конца не изучен. В организме окислительно-восстановительные реакции могут осуществляться путем переноса либо электронов, либо протонов. Во многих случаях точно не известно, что именно переносится: совместно протон и электрон в виде атома Н или в отдельности – Н+ и е.
Большинство биохимических окислительно-восстановительных реакций протекают с участием ионов водорода. Например, окисление молочной кислоты до пировиноградной можно описать следующим уравнением:
СН3СН(OH)-СООН = СН3СO-СООН + 2Н+ + 2е-.
Молочная кислота Пировиноградная кислота
Окислительно-восстановительный потенциал этой системы будет зависеть от соотношения концентраций кислот и от рH раствора
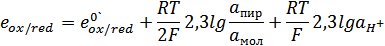
Стандартные окислительно-восстановительные потенциалы обозначаются е0‘ и связаны со стандартным электрохимическим потенциалом следующим уравнением:
е0‘ = е0 – 0,059рН = е0 -0,059·7 = е0 – 0,41В
Из шкалы стандартных биохимических потенциалов следует, что биологическое окисление характеризуется изменением потенциала от - 0,42 до +0,81В.
Электроды и цепи для определения рH.
Для измерения рH могут применяться следующие гальванические цепи:
1.Цепь, состоящая из водородного электрода и электрода сравнения:
Pt(H2) | H+ || KCl | AgCl, Ag.
Электродвижущая сила этой цепи будет равна:
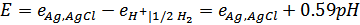
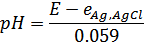
2.Цепь из хингидронного электрода и любого электрода сравнения:
Hg, Hg2Cl2 |KCl ||H+ |Pt.
Хингидронный электрод имеет более положительный потенциал, чем каломельный, поэтому его следует писать справа. Э.д.с. этой цепи соответственно будет равна:
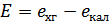
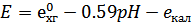
Тогда
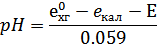
3.Наиболее применяемые электрохимические цепи, состоящие из стеклянного электрода сравнения(хлорсеребряного или каломельного):
Стекл. эл. | H+ ||KCl |Hg2Cl2,Hg.
или
Стекл. эл. | H+ ||KCl АgCl,Аg
Эти цепи также калибруют по буферным растворам, строят калибровочный график и по графику определяют рH исследуемого раствора.
4. концентрационные цепи, состоящие из двух индикаторных электродов, опущенных в растворы с различными концентрациями ионов водорода, например:
Pt(H2) | H+ || H+ | Pt (H2).
Для подобных цепей
E=0, 059 lg 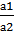 , или E=0,059 (рН2-рН1).
, или E=0,059 (рН2-рН1).
Для измерения pH можно использовать концентрационную цепь из двух стеклянных электродов, один из которых опущен в стандартный раствор с известным значением pH:
Стекл.эл. |pH ||pHx| стекл.эл. ;
|Cт.||иссл.|
E 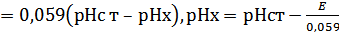
Подобные цепи применяют для определения pH различных жидких сред организма: желудочного сока, крови. Кровь, как уже отмечалось, является буферной системой. Чтобы сравнить pH крови в норме и патологии, необходимо иметь возможность различать небольшие изменения pH. Для этого pH крови измеряют с помощью концентрационной цепи, где в качестве стандартного раствора применяют фосфатный буфер, состоящий из соли KH2PO4 и Na2HPO4 в моляльном соотношении 1: 3, 5 (pH=7,388 при Т=311 К).
Мембранные электроды представляют собой стеклянную мембрану, по разные стороны которой находятся кислые растворы различной концентрации. Представителем данного вида электродов является стеклянный электрод. Он состоит из стеклянной трубки с шариком на конце, который заполнен буферным раствором или 0,1 М HCl. В этот раствор помещают внутренний электрод сравнения – Ag | AgCl. Стеклянный электрод погружают в исследуемый раствор, содержащий ионы H3О+. Ag | AgCl | HCl | H3О+р-р.Стеклянная мембрана готовится из алюмосиликатного стекла с натриевой или водородной функцией. На границе стеклянная мембрана – раствор идет обмен ионами:
Ме+(стекло)+Н+(раствор)↔ Ме+(раствор)+Н+(стекло)
Потенциал, который возникает, зависит от концентрации H3О+в растворе, то есть от рН среды.
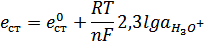
при T=298 K 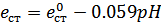
Потенциал стеклянного электрода зависит от рН раствора, и электрод используется как индикаторный.








