1.8. Электрическая подвижность иона
Скорость движения иона при единичном градиенте электрического потенциала (1 В/м) называют электрической подвижностью иона, которая зависит от заряда и вязкости среды. Для подавляющего большинства ионов в водных растворах при бесконечном разведении электрические подвижности, а следовательно, и эквивалентные электропроводности мало отличаются друг от друга, поскольку размеры гидратированных ионов близки. Наибольшую электрическую подвижность имеют ион водорода и гидроксид-ион.
Высокая электрическая подвижность этих ионов объясняется особым механизмом переноса заряда (его называют эстафетным механизмом или гротгусовским). В водных растворах ион водорода Н+ в свободном виде не существует, так как энергия ионизации атома водорода очень велика. Обычно ион водорода записывают в виде иона гидроксония Н3О+.
Сущность эстафетного механизма состоит в следующем. Во внешнем электрическом поле гидратированные ионв водорода не только перемещаются (мигрируют) к соответствующему электроду вместе со своей гидратной оболочкой, но и перескакивают от одной молекулы воды к другой, так что электричество переносится ионами водорода как за счет миграции, так и за счет их перескока.
Рассмотрим перенос электричества ионами водорода. В жидкой воде все молекулы водя связаны между собой водородными связями, образуя единую подвижную структуру. При перемещении положительно заряженного иона гидроксония к катоду во внешнем электрическом поле ион водорода Н+ передается – перескакивает от иона гидроксония к соседней молекуле воды, образуя новый ион гидроксония в направлении движения к катоду. Из этого вновь образовавшегося иона гидроксония протон снова передается (перескакивает) к следующей молекуле воды в направлении движения к катоду – и так далее, что можно условно представить следующей схемой для фрагмента воды в кислом растворе:
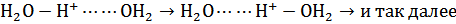 . (17)
. (17)
Повышенную подвижность ионов ОН- в водных растворах также предположительно объясняют передачей – перескоком протонов от молекул воды к ионам ОН- в направлении, противоположном направлению перемещения гидроксильных ионов в соответствии с условной схемой:
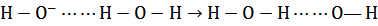 . (18)
. (18)
Связи О-Н в ионах гидроксония менее прочные, чес связи О-Н в молекулах воды, их разрыв осуществляется легче, поэтому подвижность водородных ионов выше подвижности гидроксильных ионов.
1.9. Метод экспериментального измерения электропроводности
Электропроводность – величина, обратная сопротивлению. Поэтому ее определение практически сводится к измерению сопротивления электролитов. В связи с тем, что при пропускании через электролит постоянного тока на электродах происходят процессы, резко увеличивающие сопротивление системы (поляризация), сопротивление электролитов обычно измеряют с помощью переменного тока высокой частоты. Электрическую проводимость измеряют при помощи мостика Кольрауша (рис. 5).
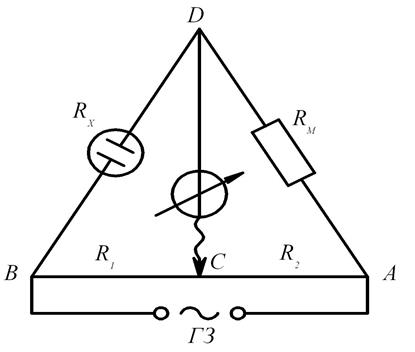
Рис. 5. Схема установки для определения электропроводности
(мостик Кольрауша): RM – магазин сопротивлений;
R1 и R2 – плечи мостика; RХ – сосуд с раствором электролита
По закону Кирхгофа в точке А мостика ток разветвляется и идет по ACB и ADB. Можно найти такое положение контакта С, при котором ток через ветвь CD не идет, что соответствует минимальному сигналу нуль-инструмента. Это происходит при равенстве потенциалов в точках С и D, чему отвечает условие равенства падения напряжения на участках AС и AD и, соответственно, на участках CB и DB. Тогда условие баланса мостика запишется так:
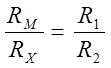 . (19)
. (19)
Во избежание электролиза, влекущего изменение концентрации электролита, и поляризации электродов необходимо при измерениях применять ток высокой частоты. Такой ток получают с помощью генератора звуковых частот. В качестве нуль-инструмента (индикатора), который устанавливает отсутствие тока в цепи, может быть использован низкоомный телефон, гальванометр переменного тока или осциллограф.
В мостике переменного тока достигнуть полного равенства потенциалов в точках C и D нельзя, потому что в цепи переменного тока, кроме активного омического сопротивления, существует реактивное сопротивление. Равновесие в этом случае определяется отношением не сопротивлений, а импедансов. Чтобы добиться полного равенства потенциалов в точках С и D, нужно устранить реактивное сопротивление в отдельных ветвях измерительного контура. Для этого следует брать короткие соединительные провода, контакты тщательно зачищать и припаивать, ветви мостика экранировать, а экран заземлять. Однако все эти меры не устраняют емкостного сопротивления электрической ячейки. Наличие емкостного сопротивления не позволяет свести к нулю силу тока на ветви CD. Поэтому находят положение контакта С, при котором сила тока оказывается наименьшей. Это отвечает, например, наименьшей силе звука в телефоне или минимальной амплитуде синусоиды на экране осциллографа. При точных измерениях емкостные сопротивления компенсируют с помощью дополнительного конденсатора, переменной емкости, включенного в ветвь постоянного сопротивления.
1.10. Растворимость и произведение растворимости
малорастворимых соединений
По величине удельной электропроводности насыщенного раствора труднорастворимой соли можно найти ее концентрацию, следовательно, вычислить растворимость и произведение растворимости. Если электропроводность растворов электролитов измерить при различных температурах, то на основании полученных данных можно рассчитать изменение термодинамических функций процесса растворения:  ,
,  ,
, 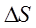 .
.
Зависимость растворимости от температуры выражается уравнением Шредера
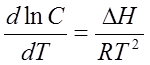 , (20)
, (20)
где 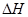 – дифференциальная теплота растворения; С – концентрация насыщенного раствора.
– дифференциальная теплота растворения; С – концентрация насыщенного раствора.
Уравнение (20) может быть применимо к насыщенным растворам труднорастворимых соединений. Интегральная форма этого уравнения позволяет рассчитать дифференциальную теплоту растворения, если известна растворимость при двух температурах. В насыщенном растворе существует равновесие между твердой солью и ее раствором:
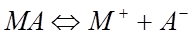 .
.
Для этого процесса константа равновесия выражается как
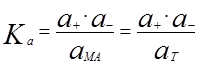 , (21)
, (21)
где 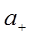 и
и 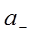 – активности катиона и аниона;
– активности катиона и аниона; 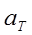 – активность твердой соли. При данной температуре произведение
– активность твердой соли. При данной температуре произведение 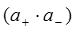 – величина постоянная и называется произведением растворимости
– величина постоянная и называется произведением растворимости
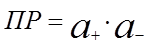 . (22)
. (22)
При малой растворимости соли коэффициент активности практически равен единице, следовательно,
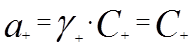 . (23)
. (23)
Тогда произведение растворимости соли может быть выражено уравнением
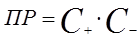 , (24)
, (24)
где 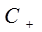 и
и 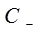 – концентрации катиона и аниона.
– концентрации катиона и аниона.
Уравнение (20) для нахождения дифференциальной теплоты растворения может быть преобразовано: для одно-одновалентного электролита
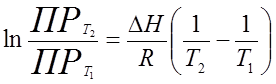 . (25)
. (25)
Дифференциальную теплоту растворения труднорастворимых соединений можно также определить графически по тангенсу угла наклона в координатах 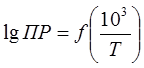 исходя из неопределенного интегрирования уравнения (20)
исходя из неопределенного интегрирования уравнения (20)
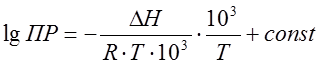 . (26)
. (26)
Из полученного значения ПР рассчитывают 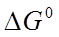 :
:
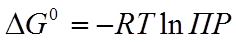 . (27)
. (27)
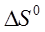 растворения рассчитывают согласно уравнению (16).
растворения рассчитывают согласно уравнению (16).








