1. Электрическая проводимость растворов электролитов
ЭЛЕКТРОХИМИЯ
Электрохимия – это раздел физической химии, в котором изучаются законы взаимного превращения химической и электрохимической форм энергии и системы, где эти превращения осуществляются.
В зависимости от природы токопроводящих частиц и от их электропроводности все вещества можно условно разделить на пять основных групп:
- непроводящие тела или изоляторы – вещества, в которых даже при больших электрических полях не наблюдается прохождения тока;
- проводники I рода или электропроводящие тела – вещества, электрическая проводимость которых обусловлена электронами. К ним относятся металлы, их некоторые оксиды, углеродистые материалы. Удельное сопротивление лежит в пределах 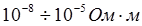 ;
;
- полупроводники – вещества, ток в которых переносится электронами и дырками. По электропроводности они располагаются между изоляторами и металлами. Удельное сопротивление полупроводников изменяется в широких пределах от 10-7 до 103 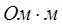 ;
;
- проводники II рода – вещества, обладающие ионной проводимостью (твердые соли 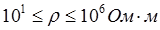 , ионные расплавы
, ионные расплавы  , растворы электролитов
, растворы электролитов 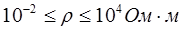 );
);
- смешанные проводники – вещества, сочетающие электронную и ионную проводимости.
В электрохимии рассматривают проводники второго рода.
1. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
1.1. Движение ионов в электрическом поле
Согласно теории Аррениуса, молекулы электролитов в водном растворе диссоциируют на электрически заряженные частицы – ионы, которые и являются переносчиками электричества. Не все электролиты диссоциируют в одинаковой степени: одни – сильные электролиты – диссоциируют в растворе полностью; другие – слабые электролиты – диссоциируют частично. Электропроводность слабых электролитов определяется степенью диссоциации α, которая зависит от концентрации электролита и температуры. В растворе слабого электролита между недиссоциированными молекулами и ионами устанавливается равновесие:
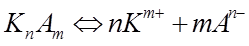 .
.
Независимо от степени диссоциации электролита соблюдается электронейтральность раствора, т.е. числа положительных и отрицательных зарядов в растворе равны.
Ионы в растворе электролита находятся в непрерывном беспорядочном движении. При наложении внешнего электрического поля на хаотичное тепловое движение ионов накладывается ориентированное поступательное движение к поверхности электродов. На скорость передвижения катионов и анионов в преимущественном направлении влияет ряд факторов:
а) размер иона: чем меньше ион, тем он более подвижен. При этом следует помнить, что ионы в водном растворе гидратированы, а значит, речь идет о размерах гидратированного иона;
б) заряд иона: скорость движения иона тем больше, чем выше его заряд;
в) напряженность внешнего электрического поля (отношение разности потенциалов между электродами к расстоянию между ними); чтобы исключить влияние этого фактора, принято сравнивать абсолютные скорости движения ионов: абсолютной скоростью иона назы вают скорость его передвижения в поле с напряженн стью 1 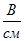 ;
;
г) концентрация электролита: с уменьшением концентрации электролита в растворе абсолютные скорости ионов растут, так как увеличивается расстояние между ними и уменьшаются силы электростатического взаимодействия. При бесконечном разбавлении С→0 абсолютные скорости ионов достигают максимального значения;
д) температура: абсолютная скорость движения любого иона тем больше, чем меньше вязкость растворителя η. С увеличением температуры вязкость растворителя уменьшается, а абсолютная скорость движения ионов растет;
е) аномально высокими значениями абсолютных скоростей в водных растворах обладают ионы Н3О+ и ОН-, что принято объяснять особым механизмом движения этих ионов в водных растворах – эстафетным.
Между ионами гидроксония Н3О+ и молекулами воды Н2О, а также гидроксидионами ОН- и Н2О происходит обмен ионами Н+. Эти процессы протекают с огромной скоростью – средняя продолжительность существования иона Н3О+ составляет около 10-11 с. В отсутствие внешнего поля такой обмен протекает в любых направлениях; под действием электрического поля передача ионов Н+ происходит направленно.
Величина, характеризующая способность веществ проводить электрический ток под действием внешнего электрического поля, называется электрической проводимостью (электропроводностью) .
Для оценки проводимости растворов и влияния на нее различных факторов на практике используют величины удельной электропроводности χ, эквивалентной электропроводности λ и молярной электропроводности μ.
1.2. Удельная электрическая проводимость
Удельной электрической проводимостью χ называют электропроводность раствора, находящегося между параллельными электродами площадью 1 м2, расположенными на расстоянии 1 м. Размерность удельной электропроводности 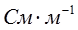 (СИ) или
(СИ) или 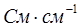 (СГС), где 1См = 1Ом-1. Физический смысл удельной электропроводности – электропроводность единицы объема.
(СГС), где 1См = 1Ом-1. Физический смысл удельной электропроводности – электропроводность единицы объема.
Удельная электропроводность обратно пропорциональна удельному сопротивлению:
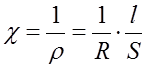 , (1)
, (1)
где ρ – удельное сопротивление проводника; R – сопротивление проводника; l – длина проводника; S – площадь поперечного сечения проводника.
Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Графическая зависимость удельной электрической проводимости водных растворов слабых и сильных электролитов от концентрации (рис. 1) проходит через точку максимума.
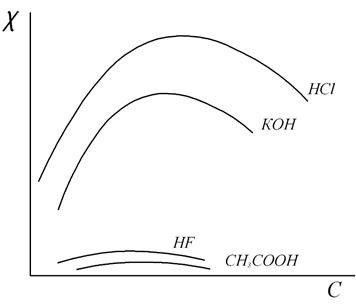 |
Рис.1. Зависимость удельной электропроводности от концентрации
На кривых зависимости удельной электропроводности от концентрации обычно наблюдается максимум. С увеличением концентрации удельная электропроводность сначала растет, поскольку увеличивается количество ионов в единице объема раствора. При дальнейшем увеличении концентрации сильных электролитов межионное взаимодействие возрастает настолько сильно, что приводит к снижению скорости движения ионов и уменьшению удельной электропроводности раствора.
В растворах слабых электролитов скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора уменьшается степень диссоциации - α. За счет снижения степени диссоциации уменьшается число ионов в 1см3 и, следовательно, уменьшается электропроводность.
Удельная электрическая проводимость растворов электролитов зависит от температуры. Повышение температуры увеличивает электропроводность растворов электролитов, так как скорость ионов растет. Для солей в водных растворах Δt ≈ 0,02, т. е. повышение температуры на 1°С приводит к увеличению электропроводности примерно на 2 %, поэтому измеряют электрическую проводимость при постоянной температуре.
1.3. Эквивалентная и молярная электрические проводимости
Эквивалентная электропроводность λ определяется как электропроводность объема раствора, в котором содержится 1 кг-экв растворенного вещества, помещенного между двумя параллельными электродами на расстоянии 1 м друг от друга с бесконечно большой площадью. Таким образом, между электродами при любой концентрации раствора находится 1 кг-экв растворенного вещества, поэтому изменение эквивалентной электропроводности при изменении концентрации раствора обусловлено изменением степени диссоциации (для слабых электролитов) или межионными взаимодействиями (для сильных электролитов).
Эквивалентная электропроводность определяется по уравнению
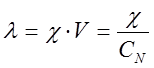 , (2)
, (2)
где V – разведение, т.е. объем, в котором содержится 1 кг-экв растворенного вещества; СN – эквивалентная концентрация (нормальная) раствора.
Размерность эквивалентной электропроводности 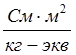 (система СИ) или
(система СИ) или 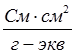 (система СГС). При переходе к системе СГС следует учитывать перевод квадратного метра (м2) на квадратный сантиметр (см2), тогда уравнение (2) примет вид
(система СГС). При переходе к системе СГС следует учитывать перевод квадратного метра (м2) на квадратный сантиметр (см2), тогда уравнение (2) примет вид
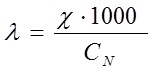 . (3)
. (3)
При разбавлении раствора эквивалентная электропроводность как сильных, так и слабых электролитов возрастает (рис. 2): для слабых электролитов – вследствие увеличения степени диссоциации α, для сильных – в результате повышения абсолютной скорости движения ионов. При бесконечном разбавлении (т.е. при бесконечно малой концентрации) эквивалентная электропроводность асимптотически приближается к предельному значению 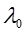 , которое называется предельной эквивалентной электропроводностью раствора при бесконечном разведении
, которое называется предельной эквивалентной электропроводностью раствора при бесконечном разведении 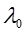 .
.
Предельная эквивалентная электропроводность раствора 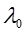 – это электрическая проводимость гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках [1]. Для слабых электролитов предельное значение
– это электрическая проводимость гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках [1]. Для слабых электролитов предельное значение 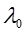 , экспериментально достичь не удается.
, экспериментально достичь не удается.
Молярная электрическая проводимость – это мера электрической проводимости всех ионов, образующихся при диссоциации 1 кмоль электролита заданной концентрации. Она численно равна электропроводности объема раствора, в котором содержится 1 кмоль растворенного вещества, помещенного между двумя параллельными электродами на расстоянии 1 м друг от друга с площадью 1 м2, и определяется по уравнению
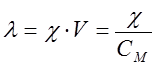 , (4)
, (4)
где V – разведение, т.е. объем, в котором содержится 1 кмоль растворенного вещества; СM – молярная концентрация раствора. Размерность молярной электропроводности 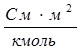 (система СИ) или
(система СИ) или 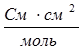 (система СГС).
(система СГС).
Характер зависимости эквивалентной электропроводности от разведения (рис. 2) для сильных и слабых электролитов различен, поскольку влияние разведения (разведение есть обратная величина концентрации) обусловлено различными причинами.
Эквивалентная электрическая проводимость растворов слабых электролитов меньше, чем сильных. Это связано с тем, что даже при низких концентрациях степень диссоциации слабых электролитов мала (α < 1), следовательно, несмотря на то, что в объеме раствора, заключенного между электродами, содержится 1 кг-экв растворенного вещества, ионов – переносчиков электрического тока в этом объеме меньше, чем в растворе сильного электролита. Повышение эквивалентной электрической проводимости слабых электролитов при разбавлении растворов связано именно с увеличением степени диссоциации (рис. 2).
В отличие от слабых электролитов сильные диссоциируют полностью (α = 1), поэтому уменьшение эквивалентной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано только с уменьшением скоростей движения ионов.
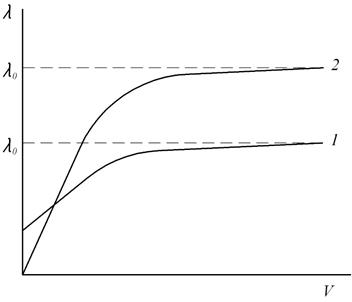
Рис. 2. Зависимость эквивалентной электропроводности от разведения:
1 - сильный электролит; 2 - слабый электролит
Дебаем и Онзагером предложена теория электрической проводимости растворов сильных электролитов. Теория представляет собой развитие основных положений электростатической теории растворов, согласно которой вокруг каждого иона формируется ионная атмосфера и свойства раствора определяются электростатическим взаимодействием центрального иона и его ионной атмосферы.
При движении иона в электрическом поле наличие ионной атмосферы вызывает появление двух эффектов, тормозящих движение иона в растворе: релаксационного эффекта, обусловленного нарушением симметрии ионной атмосферы вокруг центрального иона, и электрофоретического эффекта, обусловленного движением иона против потока сольватированных ионов противоположного знака. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для данного электролита при прочих постоянных условиях эти силы возрастают с увеличением концентрации раствора.
Для эквивалентной электропроводности ионов в растворе электролита 1,1-валентного типа с учетом двух тормозящих эффектов уравнение Дебая –Онзагера будет иметь вид:
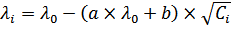 , (5)
, (5)
где
а=0,224 – коэффициент, зависящий от температуры, ионной силы, концентрации, природы электролита, диэлектрической проницаемости;
в= 50,5 – коэффициент, учитывающий помимо перечисленного еще и вязкость среды.
Уравнение Дебая-Онзагера указывает на линейную зависимость эквивалентной электропроводности от корня квадратного из концентрации.
1.4. Влияние напряженности электрического поля на электропроводность
Как было показано Вином при увеличении напряженности поля до значений 10-4 – 10-5 В/см величина электропроводности возрастает непропорционально закону Ома. Согласно теории Дебая-Хюккеля, ионная атмосфера характеризуется определенным размером и временем релаксации.
При достаточно высокой напряженности поля путь, пройденный ионом за удвоенное время релаксации ионной атмосферы, может оказаться больше, чем радиус ионной атмосферы, и ионная атмосфера не будет успевать образовываться, а обусловленные ею эффекты торможения исчезнут.
1.5. Влияние частоты электрического поля
на эквивалентную электропроводность
При невысокой частоте электрического поля ион при своем движении колеблется с частотой поля. Однако при увеличении частоты эта связь нарушается. Ион при перемещении остается в симметричном положении по отношению к ионной атмосфере и релаксационный эффект торможения исчезает, но электрофоретический эффект сохраняется. Поэтому эквивалентная электропроводность, хотя и возрастает, но не достигает предельной величины. Частота переменного тока, при которой проявляется эффект, обратно времени релаксации. Этот эффект называется дисперсией электропроводности или эффект Дебая-Фалькенхагена.
1.6. Закон Кольрауша
В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
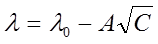 , (6)
, (6)
где λ и λ0 – эквивалентная электропроводность раствора при концентрации С и при бесконечном разведении; А – константа (при данной температуре) для данного электролита и растворителя, полученная с учетом сил релаксационного и электрофоретического торможения. При построении графика зависимости λ от  из отсекаемого участка можно установить значение
из отсекаемого участка можно установить значение  (рис. 3).
(рис. 3).
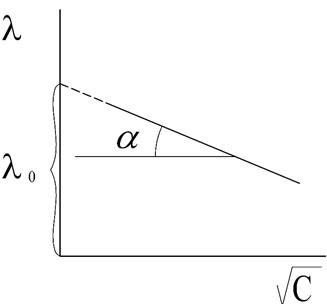
Рис. 3. Зависимость 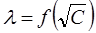 для сильного электролита
для сильного электролита
Однако для более концентрированных растворов многих одновалентных солей (например, NaCl, KCl с концентрацией С=0,001-0,1 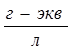 ) и для растворов слабых электролитов уравнение Кольрауша не применимо. Для них справедливо уравнение Гхоша (закон корня кубичного):
) и для растворов слабых электролитов уравнение Кольрауша не применимо. Для них справедливо уравнение Гхоша (закон корня кубичного):
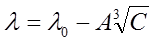 . (7)
. (7)
Согласно закону Кольрауша о независимой миграции ионов, эквивалентная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов (закон аддитивности элктропроводности):
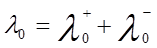 , (8)
, (8)
где 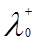 и
и 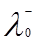 – ионные электропроводности при бесконечном разведении или подвижности катиона и аниона. Физический смысл этого закона заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
– ионные электропроводности при бесконечном разведении или подвижности катиона и аниона. Физический смысл этого закона заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
Закон формулируется в виде:
эквивалентная электропроводность электролита при бесконечно разведении равна сумме эквивалентных электропроводностей ионов, образующих молекулу электролита.
Закон применим как для сильных, так и для слабых электролитов.
В растворах слабых электролитов 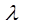 и
и 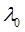 связаны со степенью диссоциации α электролита уравнением Аррениуса:
связаны со степенью диссоциации α электролита уравнением Аррениуса:
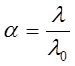 . (9)
. (9)
1.7. Закон разведения Оствальда
Для слабых электролитов, выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
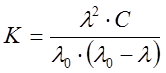 . (10)
. (10)
Приводя данное уравнение к линейной форме, получим
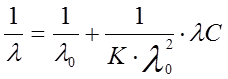 , (11)
, (11)
где 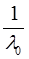 и
и 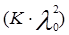 – величины постоянные. Если построить график в координатах
– величины постоянные. Если построить график в координатах 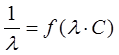 , то получаемая зависимость будет линейной с угловым коэффициентом
, то получаемая зависимость будет линейной с угловым коэффициентом 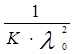 (рис. 4). Такая обработка экспериментальных данных позволяет графически определить величины константы диссоциации и эквивалентную электропроводность.
(рис. 4). Такая обработка экспериментальных данных позволяет графически определить величины константы диссоциации и эквивалентную электропроводность. 
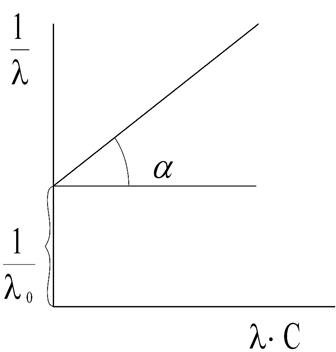
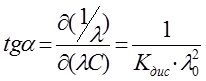
Рис. 4. Зависимость 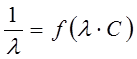 для слабого электролита
для слабого электролита
Для электролита 1,1-валентного типа закон разведения Оствальда можно записать в виде:
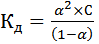 (12)
(12)
Если α<<1, то уравнение примет вид:
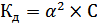 (13)
(13)
Формула (13) позволяет рассчитать степень диссоциации слабого бинарного электролита при различных концентрациях для разбавленных растворах. Степень диссоциации зависит от природы растворителя и самого слабого электролита, от температуры, от присутствия посторонних электролитов, и возрастает с уменьшением концентрации раствора данного слабого электролита.
Константа диссоциации – константа равновесия процесса диссоциации слабого электролита, поэтому по зависимости константы диссоциации от температуры для растворов слабых электролитов рассчитывают ряд термодинамических функций.
Максимально полезная работа процесса диссоциации, протекающего обратимо и изотремически, может быть рассчитана по уравнению изотермы
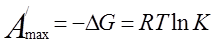 . (14)
. (14)
Если известна константа диссоциации при нескольких температурах, то по уравнению изобары можно рассчитать тепловой эффект процесса диссоциации:
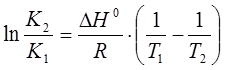 , (15)
, (15)
где К1 и К2 – константы диссоциации при разных температурах; 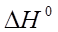 – тепловой эффект процесса диссоциации.
– тепловой эффект процесса диссоциации.
При определенных изобарно-изотермическом потенциале 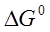 и тепловом эффекте процесса диссоциации
и тепловом эффекте процесса диссоциации 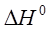 можно найти изменение энтропии
можно найти изменение энтропии 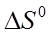 по уравнению
по уравнению
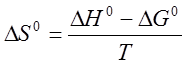 . (16)
. (16)








