2. Электролизер со свинцовыми катодами и раствором электролита (70% Н2S04).
3. Миллиамперметр.
4. Милливольтметр.
5. Пластинки металла (Ni) для полирования (аноды).
Последовательность выполнения работы
1. Собрать или проверить собранную схему установки для полирования (см. рис. 6.5).
Электролизер и миллиамперметр, соблюдая полярность (анод А «+»; катод К «–»), следует подсоединить последовательно к выпрямителю. Милливольтметр подсоединяется к электролизеру параллельно.
2. Измерить с помощью линейки площадь поверхности никелевой пластинки с обеих сторон (см2) и зачистить пластинку наждачной бумагой.
3. Присоединить пластинку к аноду и погрузить в электролизер с электролитом.
4. Снять вольт-амперную характеристику анода, для этого поставить регулятор тока выпрямителя в крайнее левое положение и включить прибор. Плавно поворачивая регулятор тока вправо, установить необходимое значение напряжения (см. табл.) и записать сразу показания миллиамперметра, не дожидаясь постоянного значения тока, при этом рассчитать цену каждого деления шкалы обоих измерительных приборов. Проводить электрополирование при 7-8 значениях величины тока. Следить за тем, чтобы напряжение на электролизере не превышало 4 В, иначе в результате окисления воды на аноде будет выделяться кислород, который вместе с водородом, выделяющимся на катоде, может образовать гремучий газ.
| Напряжение, В | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| Сила тока, А | ||||||||
| Плотность тока, А/см2 |
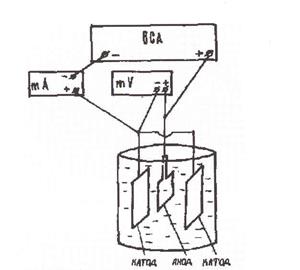
Рис. 6.5. Установка для электрополирования
5. Рассчитать плотности тока (А/см2) и на миллиметровой бумаге построить зависимость плотности тока (ось ординат) от напряжения (ось абсцисс).
6. Представить график преподавателю для получения трех режимов полирования.
7. Для полирования использовать три никелевые пластинки. Зачистить их поверхность до одинакового состояния и отполировать каждую в течение трех минут в указанных режимах, следя за величиной напряжения.
8. Осторожно (кислота концентрированная!) извлечь образцы из зажима крышки электролизера, смыть остатки кислоты под слабой струей воды из водопроводного крана и промокнуть пластинки фильтровальной бумагой.
9. Визуально определить типы дефектов на поверхности металла и по состоянию лучшего образца определить оптимальный режим полирования, записать наблюдения в тетрадь.
10. Составить уравнения электрохимических процессов, протекающих на аноде и катоде электролизера.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Объясните «ход» вольт-амперной кривой.
2. Объясните механизм электрохимического полирования.
3. Какие дефекты могут возникнуть при электрополировании и в чем причина их возникновения?
4. Какие процессы протекают на аноде и катоде при полировании алюминия, меди, никеля и железа в кислых растворах?








