Работа № 1 5 . Электролиз и его практическое применение
Цель работы – изучение процесса электролиза, основных правил разряда ионов на электродах и количественных закономерностей при протекании электродных процессов при электролизе, практическое применение электролиза для получения металлов, расчет выхода металла по току.
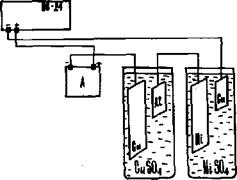
Рис. 6.4. Установка для электролиза
Оборудование (см. рис. 6.4)
1. Выпрямитель переменного тока ВС-24.
2. Кулонометр – устройство для измерения количества электричества, представляющее собой стеклянный сосуд с двумя медными пластинами (электродами), погруженными в раствор электролита, состоящего из смеси растворов СuSО4, Н2SО4 и спирта С2Н5ОН.
3.. Электролизер – стеклянный сосуд с двумя никелевыми (или
цинковыми) пластинами, опущенными в раствор электролита NiSO4 (или ZnSO4).
4. Амперметр.
5. Медная и алюминиевая пластинки (катоды) – взять у лаборанта.
Последовательность выполнения работы
1. Собрать согласно схеме или проверить предварительно собранную установку для электролиза. Кулонометр, электролизер и амперметр, соблюдая полярность, необходимо последовательно подсоединить к выпрямителю тока.
2. Подготовить поверхность катодов: алюминиевую пластинку для кулонометра и медную пластинку для исследуемого электролизера, для чего зачистить их наждачной бумагой, промыть водой и ее остатки удалить, промокнув фильтровальной бумагой.
3. Взвесить пластинки на аналитических весах. Данные записать в таблицу.
| Вес электрода до элект- ролиза | Вес электрода после элект- ролиза | Привес
металла
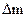
| Выход
по
току 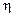 ,
% ,
%
| |
| Al-катод (кулометр) | ||||
| Cu-катод (исследуе- мый элект- ролизер) |
4. Подготовленные образцы зажать в клеммы для катодов (отрицательных полюсов) кулонометра и электролизера (см. рис. 6.4). Каждый катод поместить в соответствующий электролит на равном расстоянии от анодов так, чтобы уровень жидкости был на 3–5 мм выше расширенной части пластинок.
5. Поставить регулятор тока выпрямителя в крайнее левое положение и включить выпрямитель. Вращая регулятор тока вправо, установить требуемую силу тока (0,1 А). Плотность тока должна составлять 0,02–0,0З А/см2. Электролиз проводить 30 мин.
6. По истечении времени выключить ток, извлечь катоды из клемм, осторожно промыть водой и аккуратно промокнуть фильтровальной бумагой.
7. Взвесить пластинки на аналитических весах и результаты записать в таблицу, вычислив привес металла.
8. Рассчитать выход металла (Ni) по току по формуле
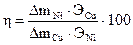 %,
%,
где Э Cu , Э Ni – эквиваленты меди и никеля, 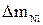 и
и 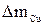 –массы меди и никеля, выделившиеся на катодах.
–массы меди и никеля, выделившиеся на катодах.
9. Написать уравнения всех электродных процессов, происходящих на аноде и катоде в кулонометре и исследуемом электролизере.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Поясните на конкретных примерах механизм процессов электролиза в растворах и расплавах электролитов с растворимым и нерастворимым анодами.
2. Какие процессы протекают на электродах при электролизе следующих водных растворов: H2SO4, NaCl, Cu(NO3)2, NiBr2?
3. Исходя из закона Фарадея, выведите формулу, по которой рассчитывается выход металла по току.
4. Что называется потенциалом разложения и какова природа процессов определяющих перенапряжение в системе?
5. Сколько грамм КОН образуется у катода при электролизе раствора, если на аноде выделилось 11,2 л кислорода, измеренных при нормальных условиях?
6. Какой толщины образуется покрытие железа при электролизе соли двухвалентного железа, если плотность тока составляет 10А/дм2, время электролиза 30 минут, выход по току 60%, а плотность железа 7,6 г/см3?








