Лабораторная работа № 5. Определение нитрат-ионов в почве
Цель работы: определить содержание нитрат-ионов в почвенных образцах.
Теоретическое обоснование
Азот – один из важнейших элементов на Земле. Продукты гниения белков и разложения мочевины – аммиак и аммиачные соли, обычно превращаются в нитраты – соли азотной кислоты.
NH3→NH4OH→NH2OH→HNO→HNO2 + 274,3 кДж
HNO2→HNO3 + 87,6 кДж
В черноземных почвах процесс нитрификации протекает более интенсивно. Накопление нитратов в почве влияет на жизнедеятельность растения. Внесение в почву азотных удобрений увеличивает содержание белка в зерновых культурах, выход муки, влияет на содержание клейковины.
Токсичность удобрений для человека и животных определяется химическим составом и агрессивностью отдельных компонентов в них. Предельно допустимая концентрация нитрат-ионов в почвах составляет 130 мг/кг.
Почвенный азот является основным питательным веществом для растений и микроорганизмов. Оптимальное соотношение необходимого для питания растений азота и азота, внесенного в почву, имеет большое значение для оценки экологического состояния данной местности. Избыточное внесение азотных удобрений в почву приводит к загрязнению грунтовых вод нитратами. Минеральные соединения азота составляют 1–5% от общего содержания азота в почве. Эти соединения представлены в основном нитратами и аммонием.Сущность метода определения нитрат-иона с использованием ионоселективного электрода состоит в приготовлении вытяжки из почвы 1%-ным раствором алюмокалиевых квасцов в измерении активности нитрат-иона с использованием ионоселективного электрода.
Определение содержания нитратов в почве по Грандваль-Ляжу проводится в день взятия пробы и при естественной влажности почвы. Метод основан на взаимодействии нитратов с дисульфофеноловой кислотой с образованием тринитрофенола (пикриновой кислоты), который в щелочной среде даёт жёлтую окраску за счёт образования тринитрофенолята калия (или натрия в зависимости от используемой щёлочи) в количестве, эквивалентном содержанию нитратов: 3HNO3 + С6Н3(НSО3)2ОН → C6H2(NO2)3ОН + 2H2SO4 + Н2ОC6H2(NO2)3OH + КОН →C6H2(NO2)3OK + Н2О желтое окрашивание Интенсивность окраски определяют на фотоколориметре.Метод определения нитратов по методу ЦИНАО в почвах, вскрышных и вмещающих породах используется при проведении экологического почвенного, агрохимического, мелиоративного обследований угодий, контроля за состоянием почв и других изыскательских и исследовательских работ. Сущность метода заключается в извлечении нитратов из почвы раствором хлористого калия, последующем восстановлении нитратов до нитритов гидразином в присутствии меди в качестве катализатора и фотометрическом определении их в виде окрашенного диазосоединения.Метод А. Ионоселективное определение концентрации
нитрат-ионов
Приборы, посуда, реактивы: иономер, ионоселективный нитратный электрод, хлорсеребряный электрод, магнитная мешалка, 1%-ный раствор алюмокалиевых квасцов, стандартные растворы нитрата калия 0,01 М, 0,001 М, 0,0001 М в 1%-ном растворе алюмокалиевых квасцов.
Ход анализа
1. Для определения нитрат-иона настраивают прибор с использованием стандартных растворов нитрата калия.
2. Переносят в стеклянный стакан 20 г воздушно-сухой почвы, приливают 50 мл 1%-ного раствора алюмокалиевых квасцов и взбалтывают 30 мин.
3. В полученной суспензии измеряют активность нитрат-ионов. Содержание нитратов в пробе определяют по показаниям прибора. Для чего после настройки прибора электроды погружают в подготовленную пробу и проводят отсчет величины
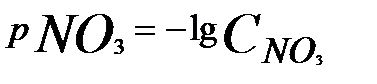 ,
,
где 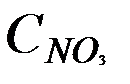 – концентрация нитрат-ионов в пробе, которую вычисляют по формуле
– концентрация нитрат-ионов в пробе, которую вычисляют по формуле
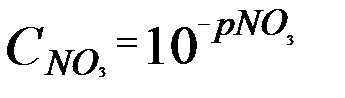
Обработка результатов
Концентрацию нитратов С в почве, мг/кг, вычисляют по формуле
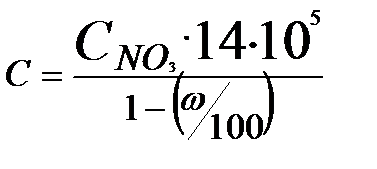
где 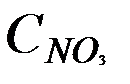 – концентрация нитратов в вытяжке, моль; 14 – атомная масса азота; 105– коэффициент, учитывающий отношение навески почвы к экстрагирующему раствору и пересчета с граммов на миллиграммы; ω – влажность почвы, взятой для анализа, %.
– концентрация нитратов в вытяжке, моль; 14 – атомная масса азота; 105– коэффициент, учитывающий отношение навески почвы к экстрагирующему раствору и пересчета с граммов на миллиграммы; ω – влажность почвы, взятой для анализа, %.
Метод Б. Определение содержания нитратов
в почве по Грандваль-Ляжу Приборы, посуда, реактивы: дисульфофеноловая кислота; 20%-ный раствор NaОН или КОН (20 г NаОН или КОН растворить в 80 см3 дистиллированной воды); лакмусовая бумага. Ход определения На технических весах берут 20 г свежей почвы и помещают в колбу объёмом 150–200 см3. Приливают цилиндром 100 cм3 дистиллированной воды (или 0,02 н. раствора K2SO4) и взбалтывают на ротаторе в течение 3 мин по песочным часам. Фильтруют в сухую посуду через воронку с двойным складчатым бумажным фильтром, стараясь перенести максимальное количество почвы на фильтр. Не следует наливать раствор в воронку более 1/2 её объёма. Если фильтрат мутный, в колбу с почвой прибавляют 3–5 г активированного угля, либо фильтруют до конца и добавляют в фильтрат 0,4 см3 7%-ного раствора щелочи и 0,6 см3 13%-ного раствора Al2(SO4)3 на 100 см3 вытяжки. Выпавший осадок отфильтровывают через чистый фильтр.Отбирают пипеткой 25–50 см3 прозрачного фильтрата и фарфоровую чашку объёмом 50–100 см3 и выпаривают содержимое на водяной бане до 1 капли. При пересушивании сухого остатка могут быть потери нитратов.Чашку снимают с водяной бани и осадок досушивают на воздухе.В фарфоровую чашку после охлаждения приливают пипеткой 1 см3 дисульфофеноловой кислоты и тщательно растирают сухой остаток небольшой стеклянной палочкой. Для удобства работы чашку ставят на специальную подставку, приливают в нее 10–15 см3 дистиллированной воды, перемешивают и опускают в раствор кусочек лакмусовой бумаги.Небольшими порциями из бюретки приливают 20%-й раствор щёлочи до окрашивания лакмусовой бумаги в синий цвет. При этом образуется комплексное соединение устойчивой жёлтой окраски. Если раствор помутнеет, добавляют 2–3 капли щёлочи, постоянно перемешивая стеклянной палочкой.Переносят количественно содержимое чашки в мерную колбу на 50 или 100 см3 через небольшую воронку без фильтра. Доводят раствор до метки, закрывают пробкой и взбалтывают. Раствор колориметрируют с синим светофильтром при длине волны 400–440 нм.Построение градуировочного графика. Приготовление стандартного раствора нитрата калия.Растворяют в дистиллированной воде перекристаллизованный KNO3 (массой 0,1631 г) в мерной колбе на 1 дм3.Приготовление образцового раствора.10 см3 стандартного раствора переносят пипеткой в мерную колбу на 100 см3 и доводят дистиллированной водой до метки. В 1 см3 полученного раствора содержится 0,01 мг NO3- или 0,00226 мг N.В мерных колбах на 50 или 100 см3 готовят стандартную шкалу в соответствии с табл. 2.4, предварительно выпарив соответствующее количество образцового раствора.Таблица 2.4Стандартная шкала| № колбы | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Количество образцового раствора, см3 | 1 | 2 | 5 | 10 | 15 | 20 | 25 |
| Содержание NO3- в колбе, мг | 0,01 | 0,02 | 0,05 | 0,10 | 0,15 | 0,20 | 0,25 |
При выпаривании небольших количеств (1–5 см3) образцового раствора. В чашку приливают 5–10 см3 дистиллированной воды во избежание пересушивания сухого остатка. Окрашивание растворов калибровочной шкалы проводится в соответствии с описанной выше методикой.Обработка результатов Содержание нитратов (в мг на 100 г почвы) рассчитывают по уравнению: 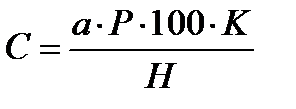 , где a – содержание нитратов по графику, мг; Р – разведение (100/Х, здесь Х – количество исходного раствора, взятого для упаривания, см3); К – коэффициент влажности почвы (учитывается только при анализе свежей почвы); Н – навеска свежей почвы, г; 100 – пересчёт на 100 г почвы.После этого рассчитывают количество азота нитратов на 100 г почвы:СN = С∙14,008/62,008, где 14,008 – масса азота; 62,008 – масса иона NO3-.
, где a – содержание нитратов по графику, мг; Р – разведение (100/Х, здесь Х – количество исходного раствора, взятого для упаривания, см3); К – коэффициент влажности почвы (учитывается только при анализе свежей почвы); Н – навеска свежей почвы, г; 100 – пересчёт на 100 г почвы.После этого рассчитывают количество азота нитратов на 100 г почвы:СN = С∙14,008/62,008, где 14,008 – масса азота; 62,008 – масса иона NO3-.
Лабораторная работа № 6. Определение содержания азота
в почве методом Кьельдаля
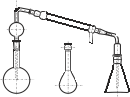
Общее количество азота (аммонийный, нитратный, нитритный и органический) в почве определяют по методу Кьельдаля, который стандартизован ИСО 11261. Сущность метода заключается в минерализации пробы до сульфата аммония, из которого выделяют аммиак для последующего анализа. Метод применим для всех типов почв.Органические соединения азота со связями типа N-N-, N-O- и некоторые гетероциклические соединения (особенно пиридин) определяются по данному методу только частично. В данном модифицированном методе вместо селена в качестве катализатора используют двуокись титана, соединения которого являются экологически менее вредными, чем соединения селена.Установка, представленная на рис.2.2, предназначена для определения азота в органических веществах.
Состоит из колбы Кьельдаля – 3 вместимостью 250 мл, испарительной колбы – 1, насадки Кьельдаля – 4, холодильника ХПТ-1-300-14/23 – 5, алонжа – 6 и конической колбы – 2 вместимостью 500 мл. Детали аппарата соединены между собой с помощью шлифов конических взаимозаменяемых по ГОСТ 8682-93, закрепленных хомутами и пружинами.

| 5 |
| 4 |
| 1 |
| 3 |
| 6 |
| 2 |
а б
Рис. 2.2. Установка для определения азота: а – классическая
установка: 1– испарительная колба; 2 –коническая колба; 3 – колба Кьельдаля; 4 – насадка Кьельдаля; 5 – холодильник; 6 – аллонж; б – дистилляционные аппараты Къельдаля Velp Scientifica.
Принцип действия основан на разложении органического вещества воздействием концентрированной серной кислоты. При этом азот переходит в аммиак, который взаимодействует с избытком серной кислоты и образует сульфат аммония. Сульфат аммония разлагают действием щелочи, а выделяющийся при этом аммиак титруют серной кислотой.
Новый аппарат UDK 127 – базовая модель в ряду дистилляционных аппаратов Къельдаля Velp Scientifica. UDK 127 разработан для выполнения многих стандартных задач, таких как определение аммонийного азота, белкового азота (отгонка по Къельдалю или прямое выщелачивание. UDK 127 оснащен новым запатентованным парогенератором, который обеспечивает абсолютно безопасный процесс работы. UDK 127 имеет функцию автоматического задания времени и добавление гидроксида натрия. Подача воды автоматически прекращается при остановках, вызванных отключением электроэнергии. Прибор оснащен системой безопасности, которая сигнализирует, если защитный чехол и пробирка не приведены в рабочее положение (без этого прибор не начинает работу). Прибор также позволяет использовать различные размеры рабочих пробирок и приемные колбы до 500 мл.
Приборы, посуда, реактивы: колбы или пробирки объемом 50 мл; аппарат для сжигания, состоящий из алюминиевого блока с просверленными отверстиями, в которые вставляют пробирки; дистилляционный аппарат; бюретки с ценой деления 0,01 мл;раствор салициловой кислоты в концентрированной серной кислоте (25 г салициловой кислоты растворяют в 1 л концентрированной серной кислоты (ρ=1,84г/см3)); каталитическая смесь (тщательно перемешивают и размалывают 200 г сульфата калия (K2SO4), 6 г сульфата меди (CuSO4∙5H20) и 6 г диоксида титана (ТiO2)); натрия тиосульфат, пудра (кристаллы тиосульфата натрия (Na2S2О8∙5H2O) должны проходить через сито с размером ячеек 0,25 мм); 10 моль/л раствор гидроксида натрия; раствор борной кислоты, с(Н3ВО3) = 20 г/л; смешанный индикатор (0,1 г бромкрезолового зеленого и 0,02 г метилового красного растворяют в 100 мл этанола); серная или соляная кислота, с(Н+) = 0,01 моль/л.Ход определения Предварительную обработку проб почвы проводят согласно требованиям ИСО 11464. В ходе предварительной обработки, если сушку проводят при высоких температурах (до 105°С), потери азота могут наблюдаться у проб с высоким содержанием аммонийного и нитратного азота.Навеску воздушно-сухой пробы около 0,2 г (при ожидаемом содержании азота до 0,5%) или около 1 г (до 0,1% азота) помещают в колбу, добавляют 4 мл раствора салициловой кислоты в концентрированной серной кислоте и вращают для тщательного перемешивания. Затем смесь выдерживают несколько часов или оставляют на ночь. После выдержки через сухую воронку по стеклянной палочке добавляют 0,5 г тиосульфата натрия осторожно нагревают смесь до прекращения вспенивания.В охлажденную колбу добавляют 1,1 г каталитической смеси и нагревают до осветления смеси. Затем смесь осторожно кипятят около 5 ч, при этом ее температура не должна превышать 400°С. Во время кипячения серная кислота конденсируется на 1/3 расстояния от поверхности смеси до шейки колбы. В большинстве случаев достаточно кипячения в течение 2 часов. После завершения этой процедуры колбу остужают и добавляют в нее при перемешивании 20 мл воды. Вращением колбы образуют суспензию и переносят ее в аппарат для дистилляции.Колбу промывают водой три раза и переносят все в дистилляционную колбу объемом 100 мл. В нее затем добавляют 5 мл раствора борной кислоты, присоединяют к конденсатору так, чтобы конец конденсатора был погружен в раствор. В воронку дистилляционного аппарата добавляют 20 мл раствора NaOH и медленно направляют ток щелочи в дистилляционную камеру. Отгоняют примерно 40 мл конденсата, промывают конец конденсатора, добавляют несколько капель индикатора в дистиллят и титруют его серной кислотой до фиолетового окрашивания.Холостую пробу обрабатывают аналогичным способом. Обработка результатовОбщее содержание азота СN в мг/г определяют по уравнению:
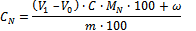 где V1 – объем серной кислоты, использованной для титрования пробы, мл; Vo – объем серной кислоты, использованный для титрования холостой пробы, мл; С – концентрация ионов водорода в серной кислоте для титрования, моль/л (если используют 0,01 M H2SO4, то С(Н+)=0,02 моль/л); MN – молярная масса азота, (MN = 14); m – масса воздушно-сухой пробы почвы, г; ω – процентное содержание воды (по массе), определенное по ИСО 11465. Результат определения округляют до двух значащих цифр.
где V1 – объем серной кислоты, использованной для титрования пробы, мл; Vo – объем серной кислоты, использованный для титрования холостой пробы, мл; С – концентрация ионов водорода в серной кислоте для титрования, моль/л (если используют 0,01 M H2SO4, то С(Н+)=0,02 моль/л); MN – молярная масса азота, (MN = 14); m – масса воздушно-сухой пробы почвы, г; ω – процентное содержание воды (по массе), определенное по ИСО 11465. Результат определения округляют до двух значащих цифр.








