Лабораторная работа № 3. Определение органического
вещества в почвах по методу Тюрина
Цель работы : определить содержание органического вещества в почвенных образцах методом Тюрина.
Таблица 2.1
Гидролитическая кислотность почвы (малогумусные),
ммоль в 100 г почвы
|
рН
| Сотые доли рН | |||||||||
| 0,00 | 0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 | |
| 6,0 | 17,3 | 16,9 | 16,6 | 16,2 | 15,8 | 15,5 | 15,2 | 14,9 | 7,59 | 7,41 |
| 6,1 | 13,9 | 13,6 | 13,3 | 13,1 | 12,8 | 12,5 | 12,2 | 12,0 | 6,11 | 5,98 |
| 6,2 | 11,2 | 11,0 | 10,8 | 10,5 | 10,3 | 10,2 | 10,1 | 9,84 | 4,92 | 4,82 |
| 6,3 | 9,04 | 8,83 | 8,65 | 8,45 | 8,28 | 8,11 | 7,92 | 7,76 | 3,96 | 3,82 |
| 6,4 | 7,28 | 7,11 | 6,97 | 6,81 | 6,69 | 6,53 | 6,38 | 6,25 | 3,19 | 3,13 |
| 6,5 | 5,85 | 5,73 | 5,61 | 5,48 | 5,37 | 5,25 | 5,14 | 5,03 | 2,57 | 2,52 |
| 6,6 | 4,71 | 4,61 | 4,52 | 4,42 | 4,32 | 4,23 | 4,14 | 4,05 | 2,07 | 2,02 |
| 6,7 | 3,79 | 3,71 | 3,63 | 3,56 | 3,48 | 3,40 | 3,33 | 3,26 | 1,67 | 1,63 |
| 6,8 | 3,05 | 2,99 | 2,92 | 2,86 | 2,80 | 2,74 | 2,68 | 2,62 | 1,34 | 1,31 |
| 6,9 | 2,46 | 2,41 | 2,35 | 2,31 | 2,25 | 2,21 | 2,16 | 2,11 | 1,08 | 1,06 |
| 7,0 | 1,98 | 1,94 | 1,90 | 1,86 | 1,82 | 1,78 | 1,74 | 1,70 | 0,87 | 0,25 |
| 7,1 | 1,60 | 1,56 | 1,53 | 1,50 | 1,46 | 1,43 | 1,40 | 1,35 | 0,70 | 0,69 |
| 7,2 | 1,28 | 1,26 | 1,23 | 1,20 | 1,18 | 1,15 | 1,13 | 1,10 | 0,56 | 0,55 |
| 7,3 | 1,03 | 1,01 | 0,99 | 0,97 | 0,95 | 0,93 | 0,91 | 0,89 | 0,45 | 0,44 |
| 7,4 | 0,83 | 0,81 | 0,80 | 0,78 | 0,76 | 0,75 | 0,73 | 0,72 | 0,37 | 0,36 |
| 7,5 | 0,67 | 0,66 | 0,64 | 0,63 | 0,61 | 0,60 | 0,59 | 0,58 | 0,29 | 0,28 |
| 7,6 | 0,54 | 0,53 | 0,52 | 0,51 | 0,49 | 0,48 | 0,47 | 0,46 | 0,24 | 0,23 |
| 7,7 | 0,43 | 0,42 | 0,42 | 0,41 | 0,40 | 0,39 | 0,38 | 0,37 | - | - |
| 7,8 | 0,35 | 0,34 | 0,33 | 0,32 | 0,31 | 0,31 | 0,30 | 0,30 | - | - |
| 7,9 | 0,28 | 0,28 | 0,27 | 0,26 | 0,26 | 0,25 | 0,25 | 0,24 | - | - |
Таблица 2.2
Гидролитическая кислотность почвы (торфяные и
другие органические горизонты), ммоль в 100 г почвы
|
рН
| Сотые доли рН | |||||||||
| 0,00 | 0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 | |
| 6,7 | 145 | 142 | 138 | 135 | 132 | 129 | 127 | 124 | 121 | 118 |
| 6,8 | 116 | 113 | 110 | 108 | 105 | 103 | 101 | 98,7 | 96,5 | 94,4 |
| 6,9 | 92,3 | 90,2 | 88,2 | 86,3 | 84,4 | 82,5 | 80,6 | 78,8 | 77,1 | 75,4 |
| 7,0 | 73,7 | 72,1 | 70,5 | 68,9 | 67,4 | 65,9 | 64,4 | 63,3 | 61,6 | 60,2 |
| 7,1 | 58,8 | 57,5 | 56,3 | 55,0 | 53,8 | 52,6 | 51,4 | 50,3 | 49,2 | 48,1 |
| 7,2 | 47,0 | 45,9 | 44,9 | 43,9 | 42,9 | 42,0 | 41,1 | 40,2 | 39,3 | 38,4 |
| 7,3 | 37,5 | 35,7 | 35,9 | 35,1 | 34,3 | 33,5 | 32,8 | 32,1 | 31,3 | 30,6 |
| 7,4 | 29,9 | 29,3 | 28,7 | 28,0 | 27,4 | 26,8 | 26,2 | 25,6 | 25,0 | 24,5 |
| 7,5 | 23,9 | 23,4 | 22,9 | 22,4 | 21,9 | 21,4 | 20,9 | 20,4 | 20,0 | 19,5 |
| 7,6 | 19,1 | 18,7 | 18,3 | 17,9 | 17,5 | 17,1 | - | - | - | - |
Теоретическое обоснование
Почвенный гумус – основа почвы, ее плодородия, адсорбционной способности и биологической деятельности. Реакции, происходящие с участием органических веществ многочисленны и разнообразны: они включают ионный обмен, буферность, сорбцию химических веществ, окислительно-восстановительные реакции. Содержание и состав органических соединений в почвах агроэкосистем оказывают огромное влияние практически на все свойства и функции этих почв. Особую роль при этом играют специфические почвенные органические соединения – вещества гумусовой природы.Влияние гумусовых веществ на плодородие почв чрезвычайно многообразно. Присутствие в почве достаточного количества гумусовых веществ способствует формированию прочной структуры и обеспечивает, таким образом, благоприятный водно-воздушный режим. Гумусовые вещества придают почве буферность в отношении элементов питания растений, особенно азота. Высокий уровень микробиологической активности почв также поддерживается высоким уровнем содержания гумуса. Таким образом, гумус является важным показателем плодородия почвы. Гумусовые вещества играют огромную роль в предотвращении или снижении поступления в растения различных загрязняющих веществ (тяжелых металлов, остаточных количеств пестицидов и т.д.).Гумус является источником поступления в почву белков, углеводов, липидов и ароматических соединений. Гумусовые вещества по растворимости и способности экстрагироваться делятся на большие группы: фульвокислоты, гуминовые кислоты и гумин. Иногда выделяют особую группу гиматомелановых кислот. Точное определение гумусовых веществ затруднено. Гумусовые вещества состоят из углерода (25–60%), кислорода (30–50%), азота (1–5%) и водорода (2–5%).Фульвокислоты – наиболее растворимая группа гумусовых соединений, обладающая высокой подвижностью, значительно более низкими молекулярными массами, чем средневзвешенные молекулярные массы гумусовых веществ в целом. Фульвокислоты – фракция органических веществ, растворимая как в кислых, так и в щелочных растворах. Содержание углерода в этих соединениях более низкое, чем у представителей других групп гумусовых веществ. Они обладают относительно более выраженными кислотными свойствами и склонностью к образованию комплексных соединений. Фульвокислотам характерна более светлая окраска, чем веществам других групп. Они преобладают в почвах подзолистого типа, красноземах, некоторых почвах тропиков, сероземах.Гуминовые кислоты – группа темно-окрашенных гумусовых соединений, которые хорошо растворяются в щелочных растворах, но не растворяются в воде и минеральных кислотах. Гуминовые кислоты имеют в среднем более высокие молекулярные массы, повышенное содержание углерода (до 62 %), менее выраженный кислотный характер. Преобладают в черноземах, каштановых почвах, иногда в серых лесных и хорошо окультуренных дерново-подзолистых. Преобладание в составе гумуса гуминовых кислот, особенно связанных с кальцием, наиболее благоприятно сказывается на плодородии почв и составе микроорганизмов в почве.
Гумусовые кислоты относятся к органическим объектам стохастического характера наряду с такими классами соединений как нефти, лигнины, таннины, хитозаны и др. По своей химической природе они представляют собой рандомизованные полимеры ароматических океиполикарбоновых кислот, в структуру которых также входят азотсодержащие и углеводные фрагменты (рис. 2.1).
В силу специфики строения, обусловленной наличием гидрофобного ароматического каркаса и богатой функциональными группами углеводно-пептидной периферии, гумусовые кислоты проявляют макролигандные свойства. Они образуют комплексы с ионами металлов и вступают в донорно-акцепторные и ван-дер-ваальсовы взаимодействия с различными классами органических соединений.
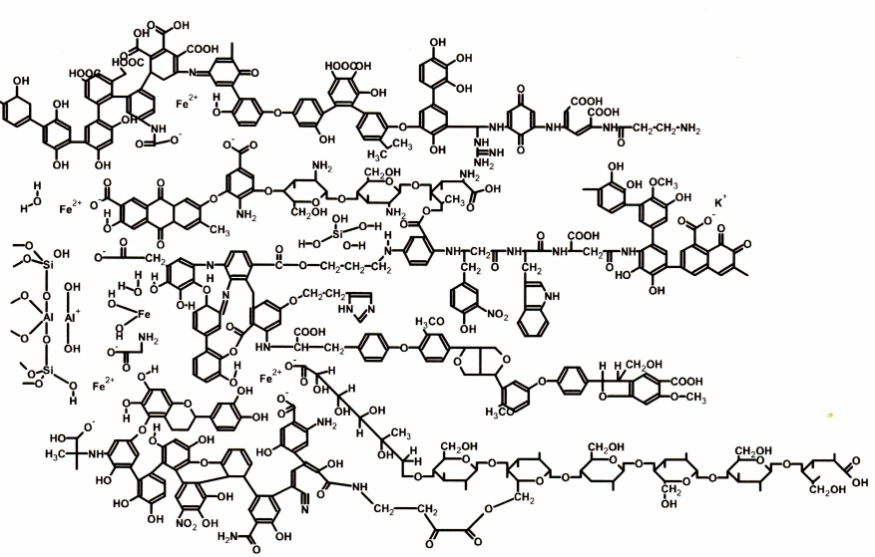
Рис. 2.1. Гипотетический структурный фрагмент гумусовых кислот (Kleinhempel, 1970)
Указанные свойства определяют протекторные функции (термин введен Д.С. Орловым) гумусовых кислот в биосфере: связывая экотоксиканты в комплексы, гумусовые кислоты снижают их биодоступность. Данное обстоятельство позволяет рассматривать гумусовые кислоты как перспективный класс соединений для получения детоксицирующих агентов природного происхождения, которые могут быть использованы в целях рекультивации водных и почвенных сред без опасности их вторичного загрязнения.
Гумин – негидролизуемая часть гумуса. Совокупность соединений гуминовых и фульвокислот, прочно связанных с минеральной частью почв.Гуминовые кислоты и гумины растворимы только в щелочном растворе и осаждаются при подкислении. Имеют молекулярную массу от 30000 до 50000, несущую отрицательный заряд и обладающую функцией кислот, которая обусловлена наличием карбоксильной и фенольной групп.Гуминовые кислоты и гумины образуют комплексы с ионами металлов, обладают большой адсорбционной способностью (как ионной, так и молекулярной). Кроме того, гуминовые вещества способны к адсорбции и абсорбции воды, а также к коагуляции.В связи с нередким переходом на использование в основном искусственного плодородия почвы (обусловленного внесением минеральных удобрений, мелиорацией и т.п. ) взамен естественного, а также ошибками в агротехнике и других приемах земледелия в ряде случаев наблюдается резкое снижение гумуса (до 50% и более от ранее наблюдавшегося содержания , например, в черноземной зоне России). Поскольку гумус необходим для нормального развития наземной растительности, в том числе сельскохозяйственных культур, потеря гумуса ведет к потенциальной опасности полного истощения почв и к опустыниванию.
При оценке гумусного состояния почв принято определять ряд показателей, из которых наиболее существенны для оценки почвенного плодородия: 1) общее содержание гумуса в почве; 2) соотношение различных типов органических соединений, входящих в состав гумуса, групповой и фракционный состав гумусовых веществ.Наиболее часто при оценке гумусного состояния почвы определяют общее содержание в почве веществ гумусовой природы. Прямое гравиметрическое определение органических веществ почвы не меняется из-за множества возникающих при этом затруднений: сложности выделения органических веществ, прочно связанных с минеральной частью почвы, возможного изменения их состава в процессе реакции, а также из-за трудоемкости анализа, что немаловажно для такого широко используемого определения.Поэтому для оценки содержания гумуса в почве прибегают к косвенным методам, основанным на разложении гумуса почвы до углекислого газа и воды. В ходе анализа определяют количество углерода, содержащегося в органическом веществе, подвергшемся разложению.Таким образом, эти методы основаны на предположении о том, чтосостав органических веществ относительно постоянен, а по количеству углерода, входящего в состав гумуса, можно судить о содержании последнего. Этот подход является единственным принятым в аналитической практике для определения содержания гумуса в почвах и, как правило, в применении к большинству используемых в сельском хозяйстве почв дает достаточно корректные оценки этого показателя.Разложение органического вещества до углекислого газа и воды может быть осуществлено методами сухого или мокрого озоления.Сухое озоление органического вещества. При использовании метода сухого озоления по Г.Г. Густавсону достигается практически полное разложение органических веществ, так как реакция протекает при температуре около 600°С. Количество выделившегося в результате разложения углекислого газа может быть определено гравиметрически, волюмометрически или титриметрически. В классической модификации этот метод отличается большой трудоемкостью и длительностью проведения анализа. Однако поскольку метод отличается высокой точностью и воспроизводимостью, то именно его обычно используют в автоматических анализаторах для определения углерода. Так как в этих приборах температура, при которой происходит сжигание, может быть установлена точно, то исключается практически единственный недостаток этого метода – возможность разложения присутствующих в почве карбонатов с выделением углекислого газа при температуре более 700°С.Мокрое озоление органического вещества. Как правило, в аналитической практике при определении углерода органических соединений используют метод Кнопа-Сабанина – мокрое озоление почвы раствором бихромата калия (К2Сr2О7) в серной кислоте. О количестве углерода органических соединений, подвергшихся мокрому озолению, можно судить как непосредственно по количеству выделившегося углекислого газа, так и по количеству окислителя, пошедшего на сжигание opганического вещества. Классический метод Кнопа-Сабанина предусматривает прямое гравиметрическое определение выделившегося при разложении органических веществ углекислого газа.Многие современные модификации предусматривают определение остаточного количества окислителя титриметрическими (метод Тюрина) или фотометрическими (метод Орлова-Гриндель) методами.
Поскольку все предлагаемые ниже методы представляют собой модификации этого подхода, т.е. мокрого сжигания органического вещества с последующим определением избытка окислителя, рассмотрим вначале общие принципы, лежащие в его основе.При химическом исследовании почвы наибольший интерес представляет, как правило, определение содержания в почве специфических гумусовых соединений. Между тем в процессе мокрого озоления разложению до углекислого газа и воды могут повергаться все органические вещества, содержащиеся в пробе, в том числе негумифицированные растительные остатки и органические вещества негумусовой природы. Поэтому при подготовке почвы к анализу особое внимание следует обратить на возможно полное отсутствие в ней корешков и различных органических остатков растительного и животного происхождения. Тем не менее, при определении общего содержания углерода органических соединений в почвах даже после тщательной подготовки проб следует иметь в виду, что получаемые результаты могут характеризовать количество углерода не только гумусовых веществ, но и не подвергшихся гумификации неспецифических органических соединений, поступивших в почву с навозом или различными компостами.Навеска почвы при определении общего содержания углерода весьма невелика, ее однородность также имеет большое значение.Из взятого в поле и доведенного до воздушно-сухого состояния образца берут среднюю пробу почвы массой около 50 г. Корни и видимые глазом органические остатки тщательно отбирают пинцетом.Раздавливают почвенные комки и вновь тщательно отбирают корешки. Почву растирают в агатовой или фарфоровой ступке и отбирают аналитическую пробу массой около 5 г, которую пропускают сито с диаметром отверстий 1 мм, и вновь отбирают корешки. В процессе отбора корешков надо неоднократно перемешивать почву и вновь распределять ее тонким слоем.Очищенную от органических остатков почву снова растирают в ступке и пропускают через сито с диаметром отверстий 0,25 мм. Трудно поддающуюся растиранию часть образца отбрасывать нельзя.Особенности мокрого озоления органического вещества почв. Озоление (окисление) органических соединений почвы до углекислого газа и воды проводят 0,4 н. раствором К2Сr2О7 в серной кислоте, разбавленной водой в соотношении 1:1. Этот реактив часто называют хромовой или окислительной смесью.Процесс окисления углерода гумуса можно условно представить уравнением: 2 К2Сr2О7+8 H2SO4+ЗС(гумуса)→2Cr2(SO4)3+2K2SO4+ 8H2O + 3СО2 Полнота окисления органического вещества составляет около 85–95%, причем в оторфованных горизонтах она обычно ниже. Она также cильно зависит от температуры и времени протекания реакции.Воспроизводимость результатов обычно невелика, и поэтому определение следует проводить в не менее чем трехкратной повторности. В классической модификации, используемой в методе Тюрина, нагревание проводят на электрической плитке. В этом случае следует весьма тщательно контролировать идентичность условий сжигания для каждой пробы. Б.А. Никитин рекомендовал проводить окисление в сушильном шкафу при температуре 150°С в течение 20 мин, что позволило несколько повысить воспроизводимость результатов и весьма упростило саму процедуру анализа. Хорошо воспроизводимые результаты дает также модификация метода, предложенная З.П. Антоновым и др. (1984).Метод мокрого озоления достаточно быстр, удобен в использовании, не требует сложной аппаратуры и в большинстве почв дает вполне приемлемые результаты. Исключение могут составлять лишь карбонатные почвы и почвы с избыточным количеством извести. Карбонаты не подвергаются разложению хромовой смесью, но образующийся при взаимодействии карбоната кальция и серной кислоты гипс может обволакивать частицы почвы, препятствуя проникновению окислительного раствора и разложению органического вещества внутри частиц.Особенности определения содержания углерода органических соединений по расходу бихромата калия. Во всех предлагаемых модификациях количество углерода органических соединений оценивается косвенно - по количеству восстановленного или оставшегося в избытке бихромата калия. Это значительно упрощает процедуру анализа, но при этом следует иметь в виду: фактически определяется не количество углерода, а окисляемость органических веществ, содержащихся в пробе, и почвы в целом.Величина окисляемости органических веществ количественно совпадает с содержанием углерода только в том случае, если соотношение водорода и кислорода в составе органических соединений равно 2. Если Н:О более 2, то получаются завышенные результаты определения углерода, так как бихромат калия вступает во взаимодействие с “избыточным” водородом. Если соотношение Н:О менее 2, окисление углерода происходит отчасти за счет кислорода самих органических соединений, что занижает результаты. Некоторые неорганические восстановители, присутствующие в почве, также могут подвергаться окислению хромовой смесью. В частности, происходит количественной окисление присутствующих в почве хлорид-ионов с выделением свободного хлора: Сr2О7 2-+ 6Сl- + 14Н+ → 2Сr3+ + ЗС12+ 7Н2О Влияние хлорид-ионов на результаты определения углерода в засоленных или удобренных хлоридными солями почвах может быть учтено при параллельном определении их в отдельной навеске. Можно также перед озолением отмыть почву от хлоридсодержащих солей.Взаимодействие закисного железа и марганца в низких степенях окисления с бихроматом, по-видимому, может оказывать заметное;влияние только при анализе невысушенных образцов почвы, что, как правило, не практикуется при определении общего содержания углерода органических соединений в почвах.Пересчет содержания углерода органических соединений на содержание гумуса. Результаты определения углерода органических соединений используются для оценки содержания гумуса в почве. Поскольку доля углерода в составе гумуса может сильно варьировать в разных почвах, и, кроме того, определяемый в пробе углерод может входить не только в состав гумуса, но и в состав неспецифических органических соединений, то такая оценка является несколько условной. Однако так называемый пересчет углерода на гумус получил широкое распространение. Обычно для этого результаты определения углерода в почве умножают на коэффициент 1,724, предполагая, что в гумусе содержится в среднем 58 % углерода.Приборы, посуда, реактивы: фотоколориметр, кюветы с толщиной слоя 1–2 см, пробирки на 20 мл, стеклянные палочки, водяная баня, пипетки на 10 мл, хромовая смесь, оксалат натрия 0,05 н.
Ход анализа
1. Из размолотой почвы отбирают представительную пробу 3–5 г для тонкого измельчения в фарфоровой ступке, затем просеивают через сито диаметром 0,25 мм. Пробы почвы помещают в пробирки, установленные в штативы.
2. Готовят хромовую смесь (200 мл 2 н. раствора серной кислоты смешивают со 100 мл 0,05 н.бихромата натрия) и раствор оксалата натрия 0,05 н.
3. В пробирки с образцами почв приливают по 10 мл хромовой смеси. Затем штативы с пробирками опускают в водяную баню, уровень воды в бане должен быть на 2–3 см выше уровня хромовой смеси в пробирках. Продолжительность нагревания суспензии 1 ч с момента закипания воды в бане после погружения в нее пробирок. Содержимое пробирок перемешивают каждые 20 мин. По истечении 1 ч штативы с пробирками помещают в водяную баню с холодной водой. После охлаждения проб добавляют 40 мл воды, вставляют до полного осветления над осадочной частью раствора.
4. Для приготовления растворов сравнения в 10 пробирок наливают по 10 мл хромовой смеси и нагревают аналогично пробиркам с пробами почвы. После охлаждения в пробирки добавляют указанные в табл. 2.3 объемы дистиллированной воды и раствора оксалата натрия, растворы тщательно перемешивают.
Таблица 2.3
Приготовление растворов сравнения
| Характеристика раствора | Номер раствора сравнения | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| Объем дистиллированной воды, мл | 40 | 38 | 36 | 32 | 30 | 25 | 20 | 15 | 10 |
| Объем раствора оксалата натрия, мл | 0 | 2 | 4 | 8 | 10 | 15 | 20 | 25 | 30 |
| Масса органического вещества, эквивалентного количеству окса- лата натрия, мг | 0 | 1,03 | 2,07 | 4,14 | 5,17 | 7,76 | 10,3 | 12,9 | 15,5 |
6. Фотометрирование растворов проводят в кювете с толщиной слоя 1–2 см относительно раствора сравнения № 1 при длине волны равной 590 нм.
Обработка результатов
Массу органического вещества в анализируемой пробе определяют по градуировочному графику, построенному по данным оптической плотности растворов сравнения.
Массовую долю органического вещества Х, %, вычисляют по формуле:
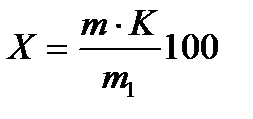 ,
,
где m – масса органического вещества в анализируемой пробе, найденная по градуировочному графику, мг; К – коэффициент поправки раствора оксалата натрия; m1 – масса пробы почвы, мг; 100 – коэффициент пересчета в проценты.








