Работа № 11. Испытание элемента Якоби-Даниэля в режиме аккумулятора
Цель работы – изучение устройства и принципа работы гальванических элементов - химических источников тока (ХИТ). Знакомство с методом измерения электродных потенциалов и электрохимических характеристик ХИТ. Показ возможности работы гальванического элемента Якоби-Даниэля в режиме аккумулятора.
А. Теоретическое введение
Элемент Якоби-Даниэля Cu│CuSO4║ZnSO4│Zn может работать в режиме разряда и заряда, т.е. выполнять роль вторичного источника тока – аккумулятора.
Электрохимическая реакция, протекающая в элементе, записывается следующим образом:
Zn + CuSO4 ↔ ZnSO4 + Cu.
При разряде происходит прямая реакция, химическая энергия которой превращается в электрическую. При заряде подведенная электрическая энергия вызывает обратный процесс.
Основной характеристикой любого источника тока является его электродвижущая сила (ЭДС), которая равна разности потенциалов катода и анода на бестоковом режиме. Для медно-цинкового элемента Якоби−Даниэля стандартная ЭДС при 298 К равна 1,1 В
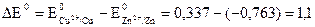 B.
B.
Величина ЭДС зависит от концентрации (активности) ионов в растворах, в которые погружены медный и цинковый электроды, и вычисляется по формуле Нернста:
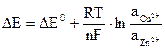 ,
,
где 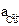 и
и 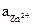 − активности соответствующих ионов.
− активности соответствующих ионов.
На практике более важным параметром, чем ЭДС, является напряжение химического источника тока при замкнутой внешней цепи – напряжение разряда. Оно всегда меньше, чем ЭДС разомкнутой цепи. Это связано с тем, что при прохождении по цепи тока вследствии явления поляризации потенциал анода сдвигается в положительную сторону, а потенциал катода – в отрицательную. Смещение потенциала электрода называется также перенапряжением:
Епол= Ei – Eо,
где Епол – потенциал поляризации (перенапряжение), Ei – потенциал электрода под током. Eо – потенциал электрода на бестоковом режиме.
Поляризация электродов может быть вызвана различными причинами. Важнейшие из них – замедленный разряд ионов, пассивация металлов, изменение концентрации ионов у поверхности электродов и др. Кроме того, часть ЭДС теряется на преодоление внутреннего сопротивления элемента (Еомич). Таким образом, напряжение элемента при разряде
Еразр = ∆Е - Епол - Еомич.
Разрядное напряжение уменьшается со временем и с увеличением плотности тока.
При заряде элемента анод и катод меняются местами и рассмотренные факторы приводят к росту зарядного напряжения по сравнению с ЭДС:
Езар = ∆Е + Епол + Еомич.
Зарядное напряжение возрастает во времени и с увеличением плотности тока. Кривая зависимости напряжения элемента от плотности тока получила название вольт-амперной характеристикой (ВАХ) или поляризационной кривой.
Б. Экспериментальная часть
Оборудование и реактивы
1. Медная и цинковая пластины.
2. Химические стаканы.
3. Электролитический ключ − U-образная стеклянная трубка, заполненная КСl и агар-агаром для увеличения вязкости раствора.
4. Переменный резистор, выполняющий роль нагрузки (R).
5. Амперметр (A).
6. Цифровой вольтметр(U).
7. Выпрямитель КЭФ-8.
8. Растворы солей: 1 М раствор ZnSO4 и 1 М раствор CuSO4.
Последовательность выполнения работы
А. Измерение ЭДС гальванического элемента.
1. Собрать модель элемента Якоби-Даниэля, для чего:
● в один из стаканчиков на одну треть налить 1 М раствор ZnSO4, а в другой – 1 М раствор CuSO4, замкнуть внутреннюю цепь, соединив электролиты электролитическим ключом;
● медную и цинковую пластины зачистить наждачной бумагой, промыть водой и осушить фильтровальной бумагой;
● опустить пластины в растворы соответствующих солей.








