Работа № 10. Определение ЭДС элемента Якоби-Даниэля
Цель работы – изучение устройства и принципа действия гальванических элементов − химических источников тока (ХИТ). Знакомство с методом измерения электродных потенциалов и электрохимических характеристик ХИТ. Изучение зависимости потенциалов электродов первого рода от концентрации катиона и измерение ЭДС элемента Якоби-Даниэля. Использование результатов электрохимических измерений для расчета термодинамических параметров реакций.
Оборудование
1. рН-метр (рН-340) − высокоомный вольтметр для измерения ЭДС.
2. Хлорсеребряный электрод сравнения.
3. Химические стаканы для растворов солей разных концентраций.
4. Электролитический ключ − U-образная стеклянная трубка, заполненная КСl и агар-агаром для увеличения вязкости раствора.
5. Медный и цинковый электроды.
Последовательность выполнения работы
1. Включить рН-метр для прогревания на 10−15 мин.
2. В три стакана налить 1 М; 0,1 М и 0,01 М растворы соли цинка.
3. Составить гальванический элемент из цинкового и хлорсеребряного электрода сравнения (Ag, AgС1|КС1нас), для чего погрузить цинковый электрод в первый из трёх стаканов, соединить U-образной трубкой электролиты обоих электродов и подсоединить их к рН-метру.
4. Замерить разность потенциалов данного гальванического элемента. Показания снимать по верхней шкале прибора (описание прибора прилагается).
5. Построить гальванические элементы из цинкового электрода с другими концентрациями соли и хлорсеребряного электрода и замерить их разность потенциалов.
6. Такие же измерения провести с медным электродом, помещенным в растворы медной соли с разной ее концентрацией и хлорсеребряным электродом.
7. Составить гальванический элемент из цинкового и медного электродов с 1 М растворами соответствующих электролитов (гальванический элемент Якоби-Даниэля), соединив растворы электролитическим ключом, и замерить разность потенциалов элемента при комнатной температуре.
На основании полученных данных
1. Рассчитать потенциалы (Еоп) цинковых и медных электродов. При этом иметь в виду, что так как потенциал медного электрода более положителен, чем потенциал хлорсеребряного электрода, величина которого при 20°С составляет величину Ех-с = 0,201В, то измеренная в опыте разность потенциалов 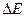 = ЕСu - Ех-с.. Для цинкового электрода:
= ЕСu - Ех-с.. Для цинкового электрода: 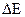 = Ех-с – ЕZn.
= Ех-с – ЕZn.
2. По формуле Нернста, используя табличные значения стандартных потенциалов медного и цинкового электродов, рассчитать теоретические значения потенциалов Етеор для электродов с разными концентрациями солей цинка и меди.
3. Рассчитать ЭДС элемента Якоби-Даниэля и сравнить ее с опытным значением измеренной разности потенциалов.
4. Полученные данные записать в таблицу и рассчитать % ошибки опытных результатов по сравнению с теоретическими.
| Схема гальванической цепи | ЭДС | Еоп | Етеор | Относительная ошибка, % |
5. Рассчитать ∆G0 реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Опишите механизм возникновения электродных потенциалов металлов. При каких условиях электродный потенциал называется стандартным (или нормальным)? Приведите формулу Нернста для расчетов потенциалов электродов 1-го и 2-го рода.
2. Рассчитайте величину электродного потенциала железа, погруженного в 0,01 М раствор соли FeS04, если кажущаяся степень диссоциации равна 40%.
3. Какова схема гальванического элемента, в котором протекает реакция
Cu + 2Ag+ = Сu+2 + 2Ag?
Рассчитайте ЭДС этого элемента и величину ∆G0.
4. Какие процессы происходят на электродах в гальваническом элементе:
(-} Mg|Mg(NO3)2||AgNO3|Ag (+)?
Определите ЭДС этого элемента.








