Работа № 9. Коллоидные растворы
Цель работы – изучение физико-химических свойств коллоидных растворов, определение порога коагуляции и защитного числа золя гидроксида железа (III).
Оборудование
1. Штатив с десятью пробирками.
2. Измерительные бюретки.
Последовательность выполнения работы
1. Для определения порога коагуляции золя гидроксида железа (III) в десять пробирок при помощи бюретки налить по 10 мл золя Fе(ОН)3 и добавить в каждую разное количество миллилитров (согласно таблице) дистиллированной воды и коагулирующего электролита − 0,00125 М раствора Na2SO4. Общий объем смеси должен составлять 15 мл.
2. Перемешать растворы во всех пробирках.
3. Знаком «+» отметить в таблице пробирки, в которых раствор помутнел (степень помутнения раствора эффективнее наблюдать на темном фоне).
| Номера пробирок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Объем воды | 4,5 | 4 | 3,5 | 3 | 2,5 | 2 | 1,5 | 1 | 0,5 | - |
| Объем р-ра Na2SO4 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 |
| Степень помутнения |
4. Рассчитать величину порога коагуляции γ, отнесенную к 1 л золя:
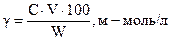 ,
,
где С − молярная концентрация электролита;
V − наименьший объем электролита Na2SO4, вызвавший коагуляцию золя;
W − объем золя, взятый для определения порога коагуляции.
5. Для определения зависимости величины порога коагуляции золя от заряда коагулирующего иона в пять чистых пробирок налить по 5 мл золя гидроксида железа Fe(OH)3, указанные в таблице количества воды и раствора электролита − 0,001 н KCl с тем, чтобы общий объем смеси был равен 10 мл. Содержимое пробирок хорошо перемешать и через 5 мин. отметить, в какой пробирке наблюдается помутнение.
6. То же проделать с растворами электролитов K2SO4 и K3[Fe(CN)6]. Полученные результаты записать в таблицу.
| Номер пробирки | 1 | 2 | 3 | 4 | 5 |
| Раствор электролита, мл | 0,5 | 1,0 | 2,0 | 3,0 | 4,5 |
| Степень помутнения KCl K2SO4 K3[Fe(CN)6] |
7. По данным таблицы построить график, откладывая на оси абсцисс логарифмы числа миллилитров 0,001 н раствора электролита, а на оси ординат 1/n , где n − величина заряда соответствующего коагулирующего иона.
8. Для определения защитного числа золя в 10 пробирок налить по 5 мл золя Fe(OH)3 и, согласно таблице, дистиллированной воды и 0,0055%-ного раствора желатина. Затем во все пробирки добавить по 2,5 мл раствора Na2SO4 и перемешать. Общий объем смеси должен быть 15 мл.
| Номер пробирки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Объем воды , мл | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | 7,0 |
| Объем раствора желатина, мл | 5,0 | 4,5 | 4,0 | 3,5 | 3,0 | 2,5 | 2,0 | 1,5 | 1,0 | 0,5 |
| Степень помутнения |
9. Отметить в таблице знаком «−» номера растворов, которые остались прозрачными.
10. Рассчитать защитное число золя S:
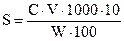 ,
,
где С − процентное содержание защищающего вещества; V − минимальный объем в миллилитрах раствора желатина, защищающего коллоидный раствор от коагуляции; W − объем золя, мл.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Какие дисперсные системы относятся к коллоидным?
2. Какой процесс подразумевают, применяя термин «коагуляция»?
3. Что такое порог коагуляции и защитное число?
4. Как устроена коллоидная мицелла золя гидроксида железа (III) Fе(ОН)3, кремневой кислоты Н2Si03, иодида серебра AgI и как называются ее составные части?
5. Дайте определение электрокинетического потенциала.








