Работа № 7. Буферные растворы
Цель работы − изучение равновесия в буферных растворах – физико-химических системах с постоянным значением кислотности среды − и определение их свойств.
Оборудование
1. pН-метр (рН-340) с датчиком.
2. Пять стеклянных колб.
3. Штатив с измерительными бюретками.
4. Мерные цилиндры.
Последовательность выполнения работы
Опыт 1
I. Приготовить пять буферных растворов, смешав О,1 н раствор уксусной кислоты СН3СООН и О,1 н раствор ацетата натрия СН3СООNa в соотношениях, указанных в таблице:
| Компоненты буферного раствора и рН | Номер колбы | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Кислота, мл | 27 | 24 | 15 | 9 | 4,5 |
| Соль, мл | 3 | 6 | 15 | 21 | 25,5 |
| рН, опытное | |||||
| рН, вычисленное | |||||
2. Измерить рН буферных растворов на рН-метре (описание прилагается к прибору) и результаты записать в таблицу.
3. По формуле (2.34) рассчитать значения рН для приготовленных буферных растворов, записать в таблицу, сравнить с опытными значениями.
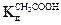 = 1,8 10-5 .
= 1,8 10-5 .
4. Построить график, отложив на оси абсцисс отношение объема соли к объему кислоты, а на оси ординат − значения рН.
Опыт 2.
Свойства буферных растворов. Буферная емкость
I. Приготовить 90 мл буферного раствора, смешав 27 мл О,1 н раствора СН3СООН и 63 мл 0,1 н раствора СН3СООNa. Разлить раствор в три колбы по 30 мл. Раствор в первой колбе оставить без изменения, во второй разбавить в два раза, в третьей − в три раза дистиллированной водой.
2. Измерить рН всех трех растворов, результаты записать. Сделать вывод о чувствительности буферного раствора к разбавлению.
3. Приготовить 150 мл буферного раствора № 1, смешав 75 мл 0,1 н раствора СН3СООН и 75 мл 0,1 н раствора СН3СООNa. Разлить раствор в пять колб по 30 мл. Добавить в колбы 0,1 н раствор щелочи в количествах, указанных в нижеследующей таблице.
4. Измерить рН полученных растворов и результаты записать в таблицу.
|
Номер колбы | Раствор № I | Раствор № 2 | ||||||||
| I | 2 | 3 | 4 | 5 | I | 2 | 3 | 4 | 5 | |
| Объем щелочи, мл | I | 2 | 3 | 4 | 5 | I | 2 | 3 | 4 | 5 |
| РН | ||||||||||
5. Приготовить раствор № 2, смешав 75 мл 0,1 н раствора СН3СООН и 75 мл 0,05 н СН3СООNa. Разлить его в пять колб по 30 мл., добавить щелочи ( см. таблицу) и определить рН. Как изменится рН буферного раствора при добавлении умеренного количества сильной щелочи?
6. По полученным данным построить кривые, отложив на оси абсцисс объем приливаемой щелочи, а на оси ординат − значения рН. Определить буферную емкость по формуле β = tgα, где α − угол наклона кривой к оси абсцисс. Сравнить величины буферной емкости растворов.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Каково практическое значение буферных растворов в природе и технике? Каков механизм их действия?
2. Какими свойствами обладают буферные растворы? Что такое буферная емкость?
3. Определите практическую значимость величин рН и рК растворов электролитов.
4. Как изменится рН раствора, если к 1.л чистой воды прибавить 0,01 моль соляной кислоты?








