Расчет электропроводности растворов
На основании полученных экспериментальных данных:
1. Рассчитать константу сосуда.
2. Рассчитать удельную и эквивалентную электропроводность исследуемого электролита для всех разбавлений.
3. Построить графики зависимостей электропроводности от концентрации æ = f(c) и λ = f(c).
4. Для слабого электролита вычислить эквивалентную электропроводность при бесконечном разведении как сумму ионных электропроводностей и для всех концентраций рассчитать степень диссоциации электролита. Построить график зависимости α = f(c).
Последовательность выполнения работы с помощью кондуктометра
1. Включить прибор в сеть переменного тока с напряжением 220 В.
2. Поместить датчик (электрод) в исследуемый раствор, перемешать раствор датчиком и включить прибор кнопкой «вкл/выкл».
3. После измерения электропроводности каждого раствора датчик промыть дистиллированной водой и просушить фильтровальной бумагой.
4. После выполнения работы выключить прибор.
5. Измерения «УЭП» снимать в мСм/см или в мкСм/см (1 См = 1 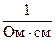 ).
).
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Дайте определения удельной и эквивалентной электропроводностей, и укажите их взаимосвязь.
2. Как изменяются с разбавлением раствора удельная и эквивалентная электропроводности?
3. Какова практическая значимость величины константы прибора φ?
4. Удельная электропроводность О,1 М раствора КОН равна 0,148 Ом-1 см2. Вычислите эквивалентную электропроводность.
5. Каково практическое значение метода измерения электропроводности растворов?
Работа № 4. Кондуктометрическое титрование
Цель работы – анализ практических возможностей метода измерения электропроводности растворов, определение концентрации раствора.
Оборудование
1. Реохордный мост для измерения сопротивления раствора (инструкция к работе на приборе прилагается).
2. Рабочая ячейка, состоящая из стеклянного стакана и платиновых электродов (получить у лаборанта).
3. Штатив с двумя бюретками.
Последовательность выполнения работы
1. Налить из бюретки в стакан 10 мл исследуемого раствора кислоты и погрузить в него электроды. Если электроды не полностью погружены в раствор, нужно добавить дистиллированной воды до уровня их погружения. 2. Измерить сопротивление раствора с помощью реохордного моста.
3. Из другой бюретки порциями по 1 мл прилить 15 мл раствора щелочи. После добавления каждой порции раствор механически перемешивать и измерять сопротивление. Результаты записывать в тетрадь.
На основании полученных данных
1. Построить график, откладывая на оси ординат сопротивление (или электропроводность) раствора, а на оси абсцисс - количество
щелочи, мл.
2. Используя уравнение (2.49), рассчитать нормальность кислоты.
3. Написать в молекулярном и ионном видах уравнение исследованной реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Приведите пример любой окислительно-восстановительной реакции, протекающей в жидкой фазе, опишите изменение состава изучаемой системы и соответственно изменение электропроводности раствора в процессе реакции по мере прибавления реагента к исходному веществу, определите точку эквивалентности.
2. Сколько г-экв кислоты присутствовало в растворе, если при титровании ее 0,1 н раствором щелочи точка эквивалентности соответствует 20 мл щелочи?
3. Определите по значениям подвижностей ионов ход кривой кондуктометрического титрования раствора AgN03 раствором HС1.








