3.1. Окислительно-восстановительные элементы
Окислительно-восстановительные гальванические элементы содержат окислительно-восстановительные электроды. К последним относятся все электроды, в реакциях на которых не участвуют ни металлы, ни газы, а только ионы и нейтральные молекулы. При реакциях на электродах в этом случае не происходит ни растворения, ни выделения каких − либо веществ из растворов электролитов, а электроды в данном случае служат только переносчиками электронов. Окислительно-восстановительные электроды представляют собой чаще всего платиновую или изготовленную из другого инертного материала пластинку, погруженную в раствор, содержащий одновременно и окисленную, и восстановленную форму одного и того же иона (например: Fe 3+ и Fe2+; Сг2О72- и Cr3+; MnO4- и Mn2+ и т.д.). Окислительно-восстановительные электрохимические реакции в данном случае связаны с изменением степени окисления элементов, входящих в состав ионов.
В практике электрохимических измерений потенциалы окислительно-восстановительных электродов, как и электродов других типов, определяются по отношению к электроду сравнения. Обычно это стандартные хлорсеребряный или каломельный электроды, относящиеся к электродам второго рода.
Процессы, протекающие при работе окислительно-восстановительных элементов, рассмотрим на конкретном примере.
Электролитом первого электрода будет служить смесь растворов солей Fe2(SO4)3 и FeSO4, которая содержит ионы железа в различной степени окисления Fe3+ и Fe2+ , а второго − смесь растворов MnSO4 и KMnO4, содержащая ионы Mn2+ и MnO4-, в которых степень окисления марганца равна соответственно +2 и +7.
Схематически эти окислительно-восстановительные электроды изображаются следующим образом:
Pt│Fe3+, Fe2+ и Pt│Mn2+, MnO4-
При погружении инертного электрода (Pt) в раствор, содержащий смесь двух солей FeSO4 и Fe2(SO4)3, на границе раздела фаз возникает окислительно-восстановительный потенциал, иначе называемый редокс (Red/Ox) потенциалом, за счет окислительно-восстановительной реакции между двумя ионами Fe2+ и Fe3+ в растворе
Fe2+ - е ↔ Fe3+ .
Уравнение Нернста для такого Red/Ox потенциала запишется следующим образом:
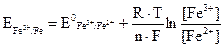
или при Т = 298 К
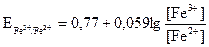 , (3.13)
, (3.13)
где 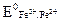 = 0,77 В − стандартный окислительно-восстановительный потенциал при [Fe3+] = [Fe2+] = 1 г-ион/л;
= 0,77 В − стандартный окислительно-восстановительный потенциал при [Fe3+] = [Fe2+] = 1 г-ион/л;
На втором электроде протекает окислительно-восстановительный процесс MnO4- + 8H+ + 5 e ↔ Mn2+ + 4H2O, потенциал которого
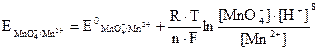
или для Т = 298 К
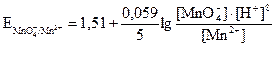 . (3.14)
. (3.14)
Схема рассмотренного гальванического элемента может быть записана следующим образом:
(-)Pt|Fe3+,Fe2+|| MnO4-,Mn2+,H+|Pt(+), (3.15)
а протекающая в нем суммарная токообразующая реакция запишется так:
● в ионной форме:
5Fe2+ + MnO4- + 8H+ +5 e →5Fe3+ + Mn 2+ + 4H2O ;
(3.16)
● в молекулярной форме:
10FeSO4 + 2 KMnO4 + 8H2SO4 →5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (3.17)
Для определения стандартной ЭДС гальванического элемента, как уже было сказано выше, следует от потенциала катода с более положительным потенциалом (окислителя) вычесть потенциал анода (восстановителя) с менее положительным значением потенциала:
∆ E0 = 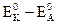 = 1,51-0,77 = 0,74 В (3.18)
= 1,51-0,77 = 0,74 В (3.18)
Процессы окисления-восстановления на электродах будут происходить до тех пор, пока их потенциалы не станут равными и в системе не установится состояние равновесия.
3.2. Концентрационные цепи и концентрационные гальванические элементы
Концентрационные цепи бывают двух родов. Концентрационные цепи первого рода содержат два металла или сплава, различающихся по концентрации активной массы или по составу сплава и погруженных в один и тот же раствор. Примером газовой концентрационной цепи первого рода может служить элемент, составленный из двух газовых, например хлорных, электродов с различными давлениями газа в приэлектродных пространствах и общим раствором электролита – соляной кислотой НСl:
(-)Cl2(p1)Pt|HCl|Cl2 (p2),Pt(+); p2>p1 (3.19)
Концентрационные цепи второго рода состоят из двух электродов одного металла, например Аg, покрытого своей нерастворимой солью АgС1, и погруженных в растворы HCl с различной активностью ионов хлора а1 и а2.
(-)Ag,AgCl|HCl||HCl|AgCl,Ag(+) (3.20)
В случае разбавленных растворов вместо величин активностей а1 и а2 можно пользоваться величинами концентраций растворов С1 и С2.
Скачок потенциала на границе раздела фаз в данном случае возникает за счет того, что на электроде, погруженном в менее активный (с меньшей концентрацией) раствор, протекает процесс окисления серебра по схеме:
Аgo + Cl- → АgCl + е.
На электроде, погруженном в более активный раствор (с большей концентрацией раствора НСl), протекает процесс восстановления хлорида серебра:
АgCl + е → Аgo + Cl-.
При работе указанного элемента оба электрода термодинамически не изменяются, а ЭДС концентрационного элемента возникает за счет диффузии ионов из мест с большей их концентрацией в более разбавленный раствор, т.е. за счет выравнивания концентраций между двумя растворами. Поэтому такие гальванические элементы называются концентрационными элементами, или цепями с переносом.
Без учета диффузионного потенциала, возникающего на границе раздела двух растворов за счет различной скорости движения ионов, электродные потенциалы анода Ea и катода Ек будут равны соответственно:
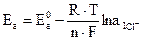 ; (3.21)
; (3.21)
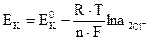 . (3.22)
. (3.22)
Так как Ек° = Еа° , а n = 1, то ЭДС (∆Е) такого концентрационного элемента
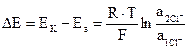 . (3.23)
. (3.23)
Для того чтобы рассчитать диффузионный потенциал, вначале следует рассмотреть процесс его возникновения. Переход НСl из раствора с более высокой активностью в менее активный осуществляется за счет диффузии ионов Н+ и С1-, скорость которой определяется их подвижностью, пропорциональной скорости движения ионов. Если градиент приложенного напряжения внешнего поля равен 1 В/см, то в данном случае скорость движения ионов называется абсолютной скоростью.
Подвижность иона (λ+ и λ-) представляет собой произведение абсолютной скорости иона (V+ и V-) на число Фарадея
λ+ = V+∙ F ; λ- = V-∙ F . (3.24)
Доля количества электричества, которую переносит данный ион, называется числом переноса иона:
катиона:
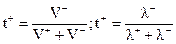 ;
;
аниона: (3.25)
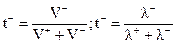 .
.
Для бесконечно разбавленного раствора:
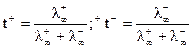 .
.
В рассматриваемом примере

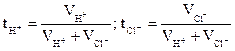 . ( 3.26)
. ( 3.26)
Сумма tH+ и tCl- равна единице. Так как подвижность иона Н+ больше, чем иона С1-, то менее концентрированный раствор будет заряжаться согласно знаку более подвижного иона Н+, т.е. будет содержать больше положительных ионов, а более концентрированный раствор − больше отрицательных ионов. Вследствие этого и возникает диффузионный скачок потенциала на границе раздела фаз, одинаковых по природе, но разных по концентрации растворов. В общем случае ЭДС концентрационного элемента
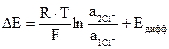 , (3.27)
, (3.27)
где 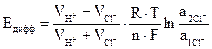 . (3.28)
. (3.28)
3.3. Потенциометрическое титрование
Потенциометрия представляет собой физико-химический метод анализа, базирующийся на зависимости электродного потенциала от состава раствора. Метод потенциометрического титрования используется для определения неизвестной концентрации раствора и основан на измерении его кислотности, или водородного показателя (pH). Он применяется также и для измерения стандартных электродных потенциалов и вычисления по их значениям термодинамических параметров реакций.
Рассмотрим в качестве примера кривую потенциометрического титрования при нейтрализации соляной кислоты HCl едким натром NaOH. При потенциометрическом титровании проводят измерения рН раствора кислоты после каждого добавления очередной порции раствора щелочи, так как в зависимости от кислотности раствора изменяется потенциал специального стеклянного электрода, применяющегося в приборах, называемых рН-метрами (описание прибора имеется в лаборатории). После снятия экспериментальных данных строят потенциометрические кривые – интегральную и дифференциальную, которые представлены на рис. 3.2. и 3.3. Первая представляет собой зависимость рН раствора от количества приливаемой щелочи х ( х – это количество г-экв NaOH, добавленных на 1 г-экв HCl). Вторая зависимость: 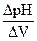 =f(x).
=f(x).
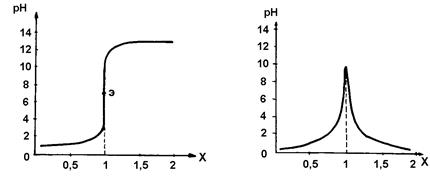
| Рис. 3.3. Дифференциальная кривая потенциометрического титрования |
Рис. 3.2. Интегральная кривая
потенциометрического титрования
Ход интегральной кривой объясняется тем, что в процессе титрования соляная кислота НС1 до полной ее нейтрализации щелочью всегда будет в избытке, а там, где имеет место избыток ионов [ 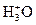 ], pН раствора будет меньше 7. В точке, где кислота и щелочь будут реагировать в количествах, равных их эквивалентам, закончится процесс нейтрализации и рН раствора будет равняться 7. Эта точка называется точкой эквивалентности. Она соответствует точке перегиба на интегральной кривой. После точки эквивалентности во всех областях в избытке будет находиться щелочь NaOH, т.е. свободные ионы ОН- и рН раствора будет больше 7.
], pН раствора будет меньше 7. В точке, где кислота и щелочь будут реагировать в количествах, равных их эквивалентам, закончится процесс нейтрализации и рН раствора будет равняться 7. Эта точка называется точкой эквивалентности. Она соответствует точке перегиба на интегральной кривой. После точки эквивалентности во всех областях в избытке будет находиться щелочь NaOH, т.е. свободные ионы ОН- и рН раствора будет больше 7.
На дифференциальной кривой точка эквивалентности будет отвечать координате «максимум», так как на оси ординат вместо рН раствора откладывают отношение 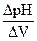 .
.
Из рис. 3.2. видно, что вблизи точки эквивалентности происходит резкое изменение рН раствора от величины, примерно соответствующей значению рН раствора HCl, до величины, примерно соответствующей рН раствора NaOH.
При потенциометрическом титровании слабой кислоты сильным основанием (рис. 3.4.) или слабого основания сильной кислотой (рис. 3.5) точка эквивалентности смещается в сторону значений рН, меньших, или больших 7
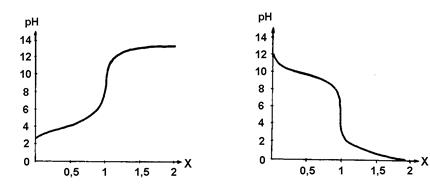
| Рис. 3.4. Кривая титрования раствора СН3СООН раствором NaOH | Рис. 3.5. Кривая титрования раствора NH4ОН раствором HCl |

 Если проводить титрование многоосновной кислоты или смеси кислот (рис. 3.6.), то с помощью потенциометрического титрования можно определить положение точки эквивалентности для каждой ступени диссоциации многоосновной кислоты или каждой кислоты смеси, если они резко отличаются друг от друга по значению константы диссоциации.
Если проводить титрование многоосновной кислоты или смеси кислот (рис. 3.6.), то с помощью потенциометрического титрования можно определить положение точки эквивалентности для каждой ступени диссоциации многоосновной кислоты или каждой кислоты смеси, если они резко отличаются друг от друга по значению константы диссоциации.
В настоящее время метод потенциометрического титрования широко применяется благодаря его высокой точности и надежности.
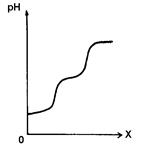
Рис. 3.6. Кривая потенциометрического титрования Н2Сr04 раствором NaOH
3.4. Окислительно-восстановительное титрование
Возможность и направление окислительно-восстановительной реакции в стандартных условиях определяется по знаку стандартного значения ЭДС окислительно-восстановительного элемента, составленного из соответствующих окислительно-восстановительных электродов. Принцип такого расчета рассмотрим на примере окислительно-восстановительной реакции
КМn04 + 5FeCl2 + 8HCl ↔ KCl + 5FеCl3 + MnCl2 + 4H2O (3.29)
Для этого сначала запишем уравнения предполагаемых электродных реакций (полуреакций), из которых складывается суммарное уравнение, и определим по справочнику значения их стандартных электродных потенциалов:
| (3.30)
(3.31) |

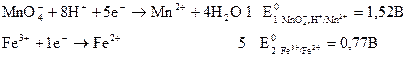
Для расчета ЭДС из потенциала, соответствующего реакции (3.30), вычитаем потенциал, соответствующий реакции (3.31) :
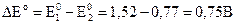 .
.
Положительное значение 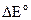 говорит о протекании реакции (3.29) при стандартных условиях в прямом направлении:
говорит о протекании реакции (3.29) при стандартных условиях в прямом направлении:
| (3.32)
|
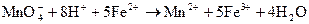 .
.
Измерение ЭДС окислительно-восстановительного гальванического элемента используется при окислительно-восстановительном титровании, когда проводят определение неизвестной концентрации раствора. Например, если необходимо определить концентрацию раствора соли FeSО4, то этот раствор титруют раствором перманганата калия KMnO4. В ходе окислительно-восстановительной реакции измеряют потенциал окислительно-восстановительной системы 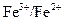 и строят график зависимости потенциала от объема прибавленного реактива. Кривая окислительно-восстановительного титрования имеет S-образный вид, абсцисса середины вертикального участка которой соответствует объему раствора КМпО4, отвечающему точке эквивалентности, а ординаты середин нижней и верхней ветвей кривой – потенциалам окислительно-восстановительных систем
и строят график зависимости потенциала от объема прибавленного реактива. Кривая окислительно-восстановительного титрования имеет S-образный вид, абсцисса середины вертикального участка которой соответствует объему раствора КМпО4, отвечающему точке эквивалентности, а ординаты середин нижней и верхней ветвей кривой – потенциалам окислительно-восстановительных систем 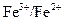 и
и 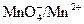 . По объему раствора KMnO4, соответствующему точке эквивалентности, можно вычислить нормальную концентрацию соли FeSО4 в растворе из равенства, основанного на законе эквивалентов: N1 V1 = N2 V2.
. По объему раствора KMnO4, соответствующему точке эквивалентности, можно вычислить нормальную концентрацию соли FeSО4 в растворе из равенства, основанного на законе эквивалентов: N1 V1 = N2 V2.
Измерение потенциалов можно проводить на рН-метре, шкала которого проградуирована как в единицах рН, так и в единицах измерения потенциала электрода.








