Глава 2. Растворы электролитов
Электролитами, как уже было сказано выше, называются вещества (кислоты, основания, соли), молекулы которых в растворах под действием молекул растворителя, чаще всего воды, распадаются на ионы – положительные катионы и отрицательные анионы. Этот процесс называется электролитической диссоциацией. Распад молекул электролитов на ионы может происходить и под воздействием высокой температуры (термическая диссоциация).
Под действием электрического тока, подаваемого от внешнего источника, в растворах или расплавах электролитов осуществляется направленное движение ионов, т.е. перенос заряда (электрический ток). Таким образом, электролиты являются ионными электрическими проводниками (проводниками второго рода) в отличие от проводников первого рода (металлов и полупроводников), которые проводят электрический ток либо за счет движения электронов, либо за счет движения электронов и дырок.
2.1. Равновесие в растворах электролитов.
Степень и константа диссоциации
Состояние динамического равновесия в растворах электролитов, при котором скорость диссоциации молекул растворенного вещества на ионы равна скорости ассоциации ионов в молекулы, характеризуется константой диссоциации, обозначаемой 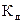 .
.
Для состояния равновесия
| (2.1)
|
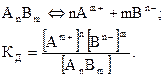
Величина 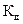 зависит только от температуры и природы веществ.
зависит только от температуры и природы веществ.
Если каждая молекула при диссоциации образует один катион и один анион ( n = m =1) то концентрации катионов и анионов, находящихся в растворе, равны [A+] =[B-]= С0∙α, где С0 — первоначальная концентрация вещества; α — степень диссоциации, представляющая собой, как сказано выше, долю молекул, распавшихся на ионы.
Число оставшихся после диссоциации непродиссоциировавших молекул [AB] = Сo - С0∙α = С0 ∙(I - α).
В этом случае значение константы диссоциации:
| (2.2)
|
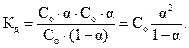
Формула (2.2) представляет собой математическое выражение закона разведения Оствальда. Если α«1 (раствор очень слабого электролита), то в знаменателе ее величиной по сравнению с единицей можно пренебречь. Тогда
| (2.3)
|
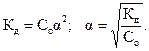
Полученное выражение наглядно показывает, что степень диссоциации с ростом концентрации раствора уменьшается. Величина константы диссоциации определяет силу электролитов. Различают очень слабые электролиты, для которых 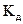 < 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 <
< 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 < 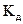 < 1O-2 , а для сильных и очень сильных соответственно 1O-2 <
< 1O-2 , а для сильных и очень сильных соответственно 1O-2 < 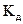 < 1О3 и
< 1О3 и
1O3 < 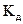 < 1О8 .
< 1О8 .
2.2. Ионное произведение воды. Кислотность растворов.
Водородный показатель (рН)
Вода является очень слабым электролитом. Её диссоциация – пример самоионизации, протекающей по уравнению
Н20 + Н20 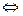 Н3O+ + ОН-,
Н3O+ + ОН-,
где Н3O+ — ион гидроксония, представляющий собой гидратированный ион водорода (Н20 + H+ = Н3O+). Константа диссоциации воды согласно закону действия масс:
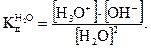 (2.4)
(2.4)
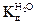 при 25оС равна 3,24∙I0-18. Так как степень диссоциации молекул воды очень мала, то концентрацию молекул воды можно считать величиной постоянной и равной [H2O] = 1000/18 = 55,55 моль/л и произведение двух постоянных величин тоже величина постоянная, равная:
при 25оС равна 3,24∙I0-18. Так как степень диссоциации молекул воды очень мала, то концентрацию молекул воды можно считать величиной постоянной и равной [H2O] = 1000/18 = 55,55 моль/л и произведение двух постоянных величин тоже величина постоянная, равная:
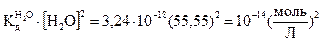 .
.
Это произведение 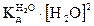 = [Н3O+][ОН-] = IO-14 = КW (моль/л)2 является постоянным для всех водных растворов. Константа КW называется ионным произведением воды, она зависит только от температуры.
= [Н3O+][ОН-] = IO-14 = КW (моль/л)2 является постоянным для всех водных растворов. Константа КW называется ионным произведением воды, она зависит только от температуры.
В нейтральном растворе концентрации [Н3O+] и [ОН-] равны:
[Н3O+] = [ОН-] =10-7моль/л. (2.5)
Концентрация ионов гидроксония [Н3O+] определяет кислотность растворов. Если [Н3O+] > 1O-7 моль/л, то раствор является кислым, если [Н3O+] < 1O-7 моль/л — щелочным. Для более удобного выражения кислотности раствора было введено понятие рH, где р — оператор, тождественно равный отрицательному десятичному логарифму р ≡ -lg. Таким образом, величина рН представляет собой отрицательный десятичный логарифм числа, определяющего концентрацию ионов гидроксония [Н3O+] или упрощенно – ионов водорода [Н+]:
pH = -lg[Н3O+]; pH = -lg[Н+]. (2.6)
Оператор р применяется и для других малых величин, например pOH = -lg[OН+,, а
р КW = pH + pOH = 14 . (2.7)
pH нейтральных сред равен 7, кислых – меньше 7, щелочных – больше 7.
2.3. Гидролиз солей.








