Изохорический процесс
Изохорический процесс происходит при постоянном объеме. Зависимость давления от температуры описывается уравнением:
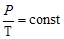 - закон Шарля , (2)
- закон Шарля , (2)
который читается: для данной массы газа при постоянном объеме давление газа линейно возрастает с увеличением температуры.
Изобарический процесс
Изобарический процесс. Это процесс, происходящий при постоянном давлении, Р= const.
Зависимость объема от температуры описывается законом:

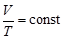 - закон Гей-Люсака, (3)
- закон Гей-Люсака, (3)
который читается: для данной массы газа при постоянном давлении объем газа линейно возрастает с ростом температуры.
Адиабатический процесс
Адиабатическим процессом называется процесс, происходящий без теплообмена с окружающей средой (dQ = 0). Он описывается уравнением Пуассона:
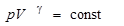 , (4)
, (4)
где g -постоянная адиабатического процесса. Постоянная адиабатического процесса равна:
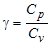 . (5)
. (5)
При адиабатическом процессе изменяются все параметры газа: давление, объем и температура.
2. Теплоемкость газа
Количество теплоты dQ , сообщенное телу при нагревании, равно
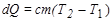 ,
,
где с - удельная теплоемкость вещества, равная количеству теплоты, сообщаемой единице массы вещества для нагревания ее на один градус.
Помимо удельной теплоемкости вводится понятие мольной теплоемкости. Мольная теплоемкость С - равная количеству теплоты, сообщаемой одному молю вещества для нагревания его на один градус.
Мольная и удельная теплоемкости связаны между собой соотношением:
С = m× с, (6)
где С - мольная теплоемкость, m - молярная масса.
Газ можно нагревать при постоянном давлении и при постоянном объеме, поэтому для газа вводятся две теплоемкости: изобарическая и изохорическая. Мольная изобарическая и мольная изохорическая теплоемкости газа связаны с соответственными соотношениями:
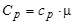 ;
; 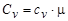 .
.
Отсюда видно, что отношение мольных теплоемкостей газа равно отношению удельных 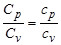 .
.
Количество теплоты, сообщенное 1 молю газа при изохорическом процессе, равно:
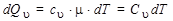 , (7)
, (7)
а при изобарическом процессе
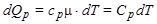 . (8)
. (8)
3 Первое начало термодинамики
Количество теплоты dQ , сообщенное термодинамической системе, расходуется на увеличение ее внутренней энергии dU и на работу dA системы против внешних сил.
dQ = dU + dA . (9)
Внутренняя энергия U- суммарная энергия всех молекул в газе для идеального газа – кинетическая энергия вращательного и поступательного движения. Для одного моля газа определяется выражением
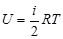 . (10)
. (10)
Работа совершаемая газом равна
dA = pdV . (11)
где dV- изменение его объема.
Применение первого начало термодинамики








