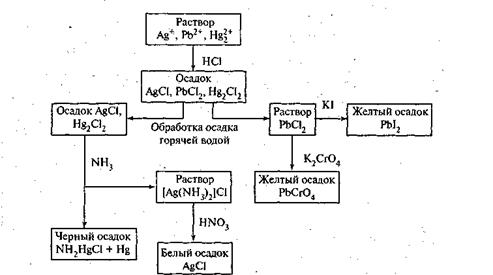
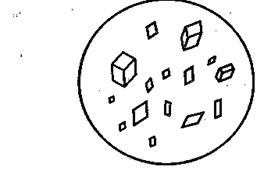
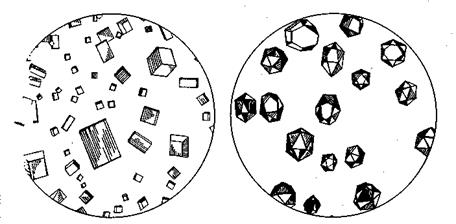
Схема 1. Анализ смеси катионов второй аналитической группы
|
|
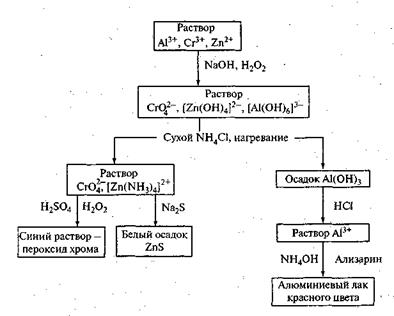
Схема 2. Анализ смеси катионов четвертой аналитической группы
|
|
|
|
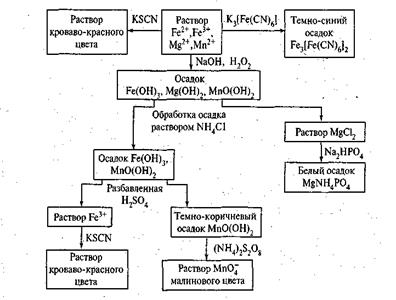
Схема 3. Анализ смеси катионов пятой аналитической группы
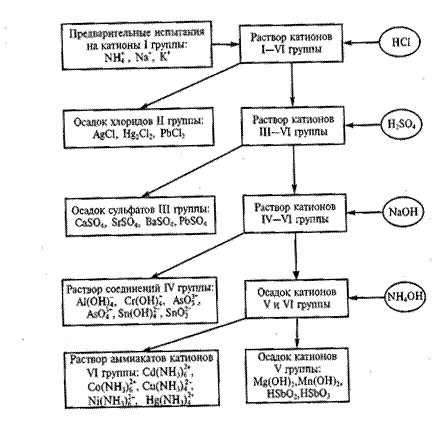
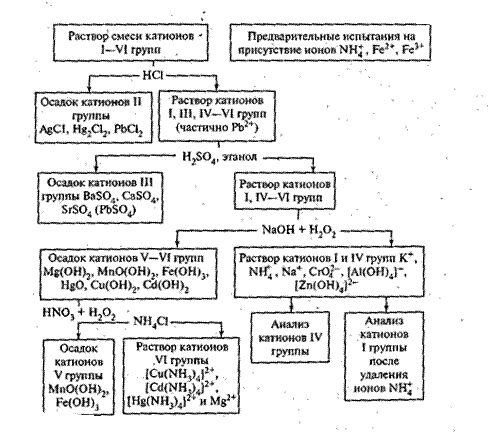
Схема 4. Анализ смеси катионов первой - шестой аналитических групп
|
|
Схема 5. Анализ смеси катионов первой - шестой аналитических групп
Кристаллы солей полученные при выполнении
микроскопических реакций
|
|
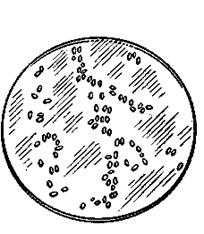
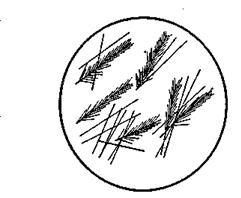
Рис 1. Кристаллы PbCu (NO2 )6
|
|
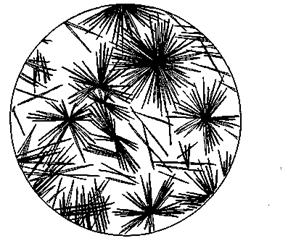
Рис 2. Кристаллы PbCu (NO2 )6 Рис 3. Кристаллы
NaMg (UO2)3 (CH3 COO)9 x 9H2O
|
|
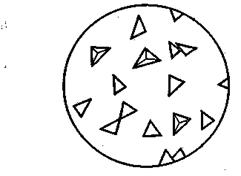
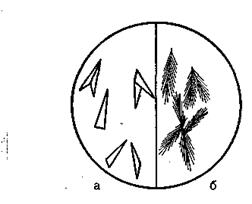
Рис 4. Кристаллы Na[Sb(OH)6 ]
|
|
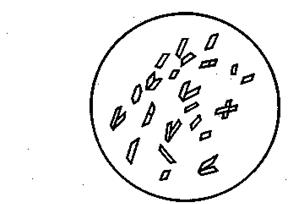
Рис 5. Кристаллы Na[UO2 (CH3 COO)3]
|
|
Рис 6. Кристаллы CaSO4 x 2 H2O
|
|
Рис 7. Кристаллы CaSO4 x 2 H2O
|
|
Рис 8. Кристаллы Zn[Hg (SCN)4 ]
|
|
Рис 9. Кристаллы MgNH4 PO4 x 6H2O
|
|
Рис 10. Кристаллы MgNH4PO4 x 6H2O
Тема 8. ОСНОВЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА
Содержание:
1. Задачи и методы количественного анализа
2. Гравиметрический анализ
2.1. Характеристика гравиметрического анализа
2.2. Условия осаждения (выбор осадителя, количество осадителя, влияние температуры
3. Этапы гравиметрического анализа
3.1 Подготовка тиглей
3.2 Осаждение
3.3 Фильтрование и промывание осадка
3.4 Высушивание и прокаливание осадка
3.5 Вычисление результатов анализа
1.ЗАДАЧИ И МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА
Задачей количественного анализа является определение количественного
содержания отдельных составных частей в исследуемом веществе. Количественный анализ используется в биологии, физиологии, медицине, биохимии, химии пищевых продуктов, фармации и т.д.
Все методы количественного анализа подразделяются на химические, физико-химические и физические. К химическим методам относятся гравиметрический, титриметрический и газовый анализы, к физико-химическим – фотометрия, электрохимический и хроматографический анализы, к физическим – спектральный анализ, люминесцентный.
1. Гравиметрический анализ основан на определении массы вещества, выделенного в чистом виде или в виде соединения известного состава. Например, чтобы определить количество бария в его соединениях, ион Ва2+ осаждают при помощи разбавленной серной кислоты. Осадок ВаSО4 фильтруют, промывают, прокаливают и точно взвешивают. По массе осадка ВаSО4 и его формуле вычисляют, сколько в нем содержится
бария. Гравиметрический метод дает результаты высокой точности, но он очень трудоемок.
2. Титриметрический анализ основан на точном измерении объема реактива,
затраченного на реакцию с определенным компонентом. Реактив берется в виде раствора определенной концентрации – титрованный (стандартный) раствор. Момент, когда реактив будет прибавлен в количестве, эквивалентном содержанию определяемого вещества, т.е. окончания реакции, определяется различными способами. При титровании приливают реактив в количестве, эквивалентном количеству исследуемого вещества. Зная объем и точную концентрацию раствора, пошедшего на реакцию с определяемым веществом, вычисляют его количество.
Титриметрический анализ дает менее точные результаты, чем гравиметрический, но важным его преимуществом является большая скорость выполнения анализа. В зависимости от типа реакций, протекающих в процессе титрования, титриметрический анализ включает методы кислотно-основного титрования, методы оксидиметрии и методы осаждения и комплексообразования.
3. Методы фотометрии основаны на измерении поглощения, пропускания и рассеяния света раствором. Для большинства фотометрических методов используют так называемые цветные реакции, т.е. химические реакции, сопровождающиеся изменением окраски раствора. Метод, основанный на определении содержания вещества по интенсивности окраски, называют колориметрией. Оценку интенсивности окраски раствора производят визуально или с помощью соответствующих приборов.
Иногда определяемый компонент превращают в труднорастворимое соединение и о его содержании судят по интенсивности помутнения раствора. Метод, основанный на этом принципе, называют нефелометрией. Методы колориметрии и нефелометрии применяются для определения компонентов, входящих в состав анализируемого вещества в очень малых количествах. Точность этого метода ниже, чем гравиметрического или титриметрического.
4. Электрохимические методы. К этим методам относятся электрогравиметрический анализ, кондуктометрия, потенциометрия м полярография. Электрогравиметрический метод применяется для определения концентрации металлов. Определяемый элемент осаждается путем электролиза на электроде, масса которого известна. Кондуктометрия и потенциометрия относятся к электротитриметрии. Окончание реакции при титровании устанавливают или путем измерения электропроводности раствора или путем измерения потенциала электрода, погруженного в исследуемый раствор. Потенциометрический метод применяется также для определения рН раствора. Определение основано на измерении электродвижущей силы раствора (э.д.с.), которая зависит от концентрации ионов водорода. В полярографическом методе о количестве определяемого иона судят по характеру вольтамперной кривой (полярограмма), получаемой при электролизе исследуемого раствора с капельным ртутным катодом в особом приборе – полярографе. Этот метод отличается высокой чувствительностью. Применяя полярографический метод, можно в одном и том же растворе качественно и количественно определять различные элементы, не прибегая к химическим реакциям.
5. Хроматографический метод основан на использовании явления избирательной
адсорбции растворенных веществ (или ионов) различными твердыми веществами – адсорбентами. Адсорбентами могут быть активированный оксид алюминия Al2O3, пермутит, синтетические смолы и др. Хроматографический метод применяется в качественном и количественном анализе. Особенно широко применяется этот метод для разделения веществ или ионов.
В количественном анализе различают макро-, микро и полумикрометоды. В настоящем учебнике рассматривается выполнение гравиметрических и титриметрических определений только макрометодом.
2. ГРАВИМЕТРИЧЕСКИЙ АНАЛИЗ
2.1. Характеристика гравиметрического анализа
Гравиметрическим анализом называют метод количественного химического анализа, при котором о содержании вещества в исследуемой пробе судят по его массе, полученной в результате анализа.
В большинстве случаев применяют методы осаждения. В этих случаях определяемый компонент выделяют в осадок в виде трудно растворимого соединения и определяют его массу. Перед тем как определить массу этого соединения, его высушивают и прокаливают. При этом осажденное соединение превращается в соединение другого состава. Кроме методов осаждения, значительно реже применяют методы отгонки. Этими методами можно определять только летучие соединения или такие, которые превращаются в летучие в процессе анализа.
Гравиметрический анализ находит широкое применение при санитарно-гигиенических исследованиях.
Гравиметрический анализ применяется также при анализе фармацевтических препаратов: хинина сульфата, натрия сульфата.
Для метода осаждения используются различные реакции: реакции обмена, комплексообразования, разложения. При прибавлении реактива к раствору в результате реакции определяемый компонент выделяется в осадок, например:
FeCl3 + 3NH4OH = Fe(OH)3↓ +3NH4C