Тема 7. Основы качественного анализа
Содержание:
1. Методы качественного анализа
2. Аналитические реакции и их характеристика
3. Условия проведения аналитических реакций
4. Индикаторы
5. Схемы
1. МЕТОДЫ КАЧЕСТВЕННОГО АНАЛИЗА
Первоначальная задача при исследовании любого материала – его качественный анализ на содержание наиболее распространенных неорганических ионов, поскольку знание элементного состава исследуемого состава используемого материала и степеней окисления присутствующих элементов во многом определяет его структуру и свойства. Задачи качественного химического анализа – обнаружение в исследуемом образце и идентификация строго определенных компонентов химических элементов или ионов, функциональной группы или какого-либо конкретного химического вещества.
Для обнаружения и определения веществ проводят химические реакции в сухом виде или в растворе. Испытания сухим путем проводятся при высокой температуре (пирохимический метод) или при нормальных условиях (метод растирания порошков).
При пирохимическом методе исследуемое вещество на конце платиновой проволоки, один конец которой запаян в стеклянную палочку, вносят в бесцветное пламя горелки. По окрашиванию пламени судят о наличии в пробе определенных ионов. Если данное вещество окрашивает бесцветное пламя горелки в ярко-желтый цвет. То это указывает на присутствие натрия в исследуемом веществе.
На практике применяются реакции окрашивания перлов буры. Перлы, или окрашенные стекла, готовят следующим образом: ушко платиновой проволоки нагревают и погружают в тетраборат натрия Na2B4 x 10 H2O или в гидрофосфат аммония-натрия NaNH4HPO4. Эту операцию повторяют до тех пор, пока на ушке проволоки не образуется перл. Затем на образовавшийся перл наносят исследуемое вещество (в сухом виде или в виде раствора). Ушко платиновой проволоки осторожно нагревают и прокаливают. Цвет перла после прокаливания укажет на наличие тех или иных элементов. На3пример, марганец окрашивает перл в фиолетовый цвет, хром – в зеленый.
Метод растирания порошков основан на образовании окрашенных соединений в результате реакции между двумя твердыми веществами. Если растирать сульфат кобальта с роданидом аммония, то образуется тетрароданидный комплекс кобальта, окрашенный в синий цвет:
CoSO4 + 4NH4SCN 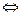 (NH4)2[Co(SCN)4] = (NH4)2SO4
(NH4)2[Co(SCN)4] = (NH4)2SO4
При растирании солей аммония с известью образуется аммиак, который легко определить по специфическому запаху или с помощью смоченной красной лакмусовой бумажки, которая синеет.
2NH4Cl + Ca(OH)2 → CaCl2 +2NH3 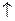 + 2H2O
+ 2H2O
Реакции, проводимые сухим путем, в качественном анализе являются вспомогательными и применяются для предварительного испытания веществ. Главную роль играют реакции, проводимые мокрым путем, происходящие между веществами в водных растворах. Исследуемое вещество должно быть предварительно растворено в дистиллированной воде или кислотах. В качестве растворителей чаще всего используют соляную и азотную кислоты, реже – царскую водку (3V K HCl + 1V K HNO3) и растворы щелочей.
Некоторые химические вещества определенного состава кристаллизируются в характерной для данного вещества форме. Для обнаружения таких веществ применяют микрокристаллоскопический анализ, в котором используют зависимость формы и физических свойств кристаллов от их состава. При проведении микрокристаллоскопического анализа на предметное стекло помещают каплю анализируемого раствора и каплю реактива. В зоне соприкосновения капель (или при их смешении) образуются кристаллы осадка. Иногда в каплю вводят кристаллик реактива для ускорения кристаллизации.
Иногда выполняют реакции капельным методом. Реакцию проводят на фильтровальной бумаге, часовом стекле, специальных пластинках с углублениями или в маленьких тиглях. На полоску фильтровальной бумаги наносят в определенной последовательности анализируемый раствор и реактивы и наблюдают появление пятен определенного цвета. На бумаге часто одновременно с обнаружением ионов происходит и их разделение. При выполнении анализа на часовых стеклах и пластинках наблюдают появление или растворение осадков или образование комплексов определенного цвета.
Методы анализа в зависимости от количества исследуемого вещества, объема раствора и техники выполнения классифицируют на макро-, полумикро-, микро-, ультра, микро, субмикро-, субультрамикрометоды .
Таблица 4.
Классификация методов анализа по массе и объему взятого для
анализа вещества
| Название | Новое название (ИЮПАК) | Масса и объем исследуемого в-ва | |
| г | мл | ||
| Макроанализ | Грамм-метод | 1 - 10 | 1-100 |
| Полумикроанализ | Сантиграм-метод | 0,05 - 0,5 | 1-10 |
| Микроанализ | Миллиграмметод | 10-6 - 10-3 | 10-4 – 10-1 |
| Ультромикроанализ | Микрограмметод | 10-9 - 10-6 | 10-6 - 10-4 |
| Субмикроанализ | Нанограмметод | 10-12 – 10-9 | 10-10 – 10-7 |
| Субультромикроанализ | Пикограмметод | 10-12 | 10-10 |
Метод анализа выбирают в зависимости от предполагаемого содержания вещества и от предела обнаружения применяемой реакции.
В настоящее время при изучении качественного химического анализа в учебных лабораториях применяют полумикрометод (полумикроанализ).
2. АНАЛИТИЧЕСКИЕ РЕАКЦИИ И ИХ ХАРАКТЕРИСТИКИ
Качественный анализ основан на применении аналитических реакций, то есть химических реакций, сопровождающихся определенным внешним аналитическим эффектом (выпадением или растворением осадка, выделением газа, изменением окраски раствора, характерной окраской пламени на определенный ион), например:
Cu2+ + 4NH3 = [Cu(NH3)4]2+
Голубой Ярко-синий
раствор раствор
Кроме ярко выраженного аналитического эффекта аналитическая реакция, применяемая в качественном анализе, должна обладать высокой чувствительностью и характеризоваться достаточной селективностью.
Чувствительность аналитической реакции характеризуется минимальным количеством определяемого компонента или минимальной его концентрацией в растворе, при которых с помощью данного реагента этот компонент может быть обнаружен.
Чувствительность реакции могут характеризовать:
- открываемый минимум (ОМ) – минимальное количество вещества, мкг, которое может быть открыто в минимальном объеме пробы (в одной капле раствора);
- предельная концентрация (Сmin) это минимальная концентрация вещества в растворе, при которой данная реакция еще дает положительный результат.
- предельное разбавление (G) – величина, обратная предельной концентрации. Предельную концентрацию выражают отношением 1:G, которое показывает, в какой массе растворителя должна содержаться одна массовая часть вещества, чтобы внешний эффект был еще заметен. Например, для реакции Cu2+ с аммиаком предельное разбавление равно 250000 и предельная концентрация 1: 250000, что означает возможность открыть ионы меди в растворе, содержащем 1г Сu2+ в 250000г воды. Реакция считается тем чувствительнее, чем больше предельное разбавление.
Чувствительность реакции зависит от многих условий: кислотности среды, температуры, ионной силы раствора и других, поэтому каждую аналитическую реакцию следует проводить в строго определенных условиях.
Селективность аналитической реакции – ее способность давать аналитический эффект с ограниченным числом веществ. Например, селективные реактивы реагируют с несколькими ионами, которые могут принадлежать к одной или к разным группам. Реактив – иодид калия (KJ) реагирует с Pb2+, Ag+, Hg22+(П группа катионов); а также с Hg2+ и Cu2+ (шестая группа).
Наивысший случай селективности – специфичность, когда аналитический эффект возникает только при наличии одного единственного вещества. Примером специфических реакций являются обнаружение иона аммония действием щелочи в газовой камере; синее окрашивание крахмала при действии йода; взаимодействие нитропруссида натрия с сульфид-ионом. При наличии специфических реакций можно было бы открыть любой ион, непосредственно в пробе исследуемой смеси, независимо от присутствия в ней других ионов. Открытие ионов специфическими реакциями в отдельных пробах всего исследуемого раствора в произвольно выбранной последовательности, называется дробным анализом.
Отсутствие специфических реакций для большинства ионов делает невозможным проведение качественного анализа сложных смесей дробным методом. Для таких случаев разработан систематический анализ. Он состоит в том, что смесь ионов с помощью особых групповых реагентов предварительно разделяют на отдельные группы. Из этих групп каждый ион выделяют в строго определенной последовательности, а потом уже открывают характерной для него аналитической реакцией.
Таблица 5.
Примеры аналитических реакций
| Реакции, процесс | Примеры уравнений реакции | Аналитический эффект | Примеры открываемых ионов и веществ |
| Осаждения | Ва2+ + SО42- = ВаSО4↓ | Образование белого осадка | Ва2+, SО42- |
| Кислотно-основные | СО32- + 2Н3О+ = СО2↑ +3Н2О | Выделение пузырьков газа | СО32- |
| Окислительно восстановительно | Mn2+ + 2H2O2 = MnO2↓ + 2H2O | Образование темно-коричневого осадка | Мn2+ |
| Комплексо образования | Fe3+ + 3SCN- =Fe(SCN)3 | Появление красной окраски раствора | Fe3+ |
| Этерификации | СН3СООН + С2Н5ОН= = СН3СООС2Н5 + Н2О | Появление запаха груши | СН3СООН |
| Экстракции | I (водн.) + С6Н6 = I2 (орг). | Фиолетовый экстракт | I2 |
Реактивы, позволяющие в определенных условиях разделять ионы на аналитические группы, называются групповыми реагентами (реактивами).
Реактивы, используемые для открытия отдельных ионов - характерные.
На практике используют оба способа (дробный и систематический) и по отдельности, и в сочетании. Для определения катионов обычно предпочитают проводить систематический анализ, а для определения ионов – дробный.
3. УСЛОВИЯ ПРОВЕДЕНИЯ АНАЛИТИЧЕСКИХ
РЕАКЦИЙ
Концентрация открываемого иона и реактива имеет большое значение. Чем чувствительнее реакция, тем меньше открываемый минимум вещества .Если реакция малочувствительна, проводить ее можно только в достаточно концентрированных растворах. Открытие ионов Ňа+ с помощью реактива K[Sb(OH)6 можно проводить в растворах не слабее 0,5 моль∕л. Обычно при выполнении качественной реакции добавляют избыток реактива. Однако слишком большого количества реактива надо избегать, так как в некоторых случаях может пойти вторичная реакция и осадок растворится. Так, например, при добавлении к находящемуся в растворе иону Hg2+ иона J- (реактив KJ) образуется красный осадок HgJ2.
Hg2+ + 2J- = HgJ2
При дальнейшем прибавлении иодида осадок HgJ2 начинает растворяться вследствии образования комплексного иона [HgJ4]2
HgJ2 + 2J- = [HgJ4]2-
Другим важным фактором является реакция среды (кислая, щелочная, нейтральная). Например, оксалат кальция СаС2О4 выпадает из раствора в слабокислой, нейтральной или слабощелочной среде, а при высокой концентрации в растворе минеральных кислот осаждения этой соли не происходит.
Большое значение имеет температура проведения реакции. Некоторые труднорастворимые соли, образующиеся в результате реакции, выпадают в осадок только при охлаждении Na[Sb(OH06]4 и KHC4H4O6. Многие реакции протекают на “холоду”
Необходимость соблюдения определенных условий справедлива и для реакций, проводимых не в растворах. Так, окрашивание пламени в характерный для данного иона цвет удается лишь при нагревании в определенной части пламени достаточно летучего соединения.
4. ИНДИКАТОРЫ
Индикатор – средство, позволяющее путем визуального наблюдения установить достижение системой определенного состояния (определенной концентрации анализируемого вещества).
Основные типы индикаторов по визуальным признакам: 1. По химической природе, типу реакции взаимодействия индикатора с соответствующим веществом титриметрической системы. В соответствии с типом реакции взаимодействия выделяют индикаторы присоединения или отдачи ионов электронов.
Все индикаторы присоединения ионов имеют сходные признаки. Они отдают или присоединяют какую-либо частицу: Н3О+ или ОН- - кислотно-основные рН-Jnq; Ме-Jnq;осадкообразующие, адсорбционные Jnq. Необходимо поддерживать постоянной концентрацию Н3О+, используя избыток сильной кислоты, основания или добавляя буферные смеси.
Jnq присоединения электронов принимают участие в реакциях О – В –редоксJnq. Окраска Jnq изменяется замедленно,а химические реакции с их участием протекают с образованием фазы промежуточных соединений. 2. По характеру обратимости Jnq реакции: обратимыми являются те Jnq, для которых наблюдаемые изменения около точки перехода окраски происходят любое число раз в одну или другую сторону при изменении концентрации соответствующего компонента титриметрической системы. Например, фенолфталеин окрашивает раствор в розовый цвет при добавлении щелочи и обесцвечивается при избытке кислоты (неограниченно). Большинство Ме Jnq и раствор Jnq- обратимы.
Необратимые Jnq-изменения вблизи Т перехода можно наблюдать только в одном направлении вследствие необратимых химических превращений, которые применяют их структуру и реакционную способность.Это многие рН-Jnq, которые относятся к присоединениям и сульфофталеинам, если их использовать при редоксиметрических титрованиях. 3.по способу применения: внутренний Jnq- введенный в анализируемый раствор;
Внешний Jnq – 1-2 капли раствора и помещают на специальную бумагу, пропитанную Jnq или смешивают с раствором Jnq на белой фарфоровой пластинке или на обычной фильтровальной бумаге. 4.по наблюдательному эффекту. а).Jnq свечения - хемилюминесцентные и флуоресцентные; б). Jnq – образование гетерофазы и изменения ее свойств – осадкообразующие, помутнения и адсорбционные. в). Jnq цвета – цветные у одноцветных Jnq окрашена только одна форма , другая бесцветна. Это нитрофенол (бесцветный при рН > 7.6 желтая), фталеин (фенолфталеин бесцветный рН>9,6
→
←
красно-фиолетовый рН<8.2 
У двуцветных Jnq окрашены обе формы. Их основные характеристики (интервал перехода окраски и показатель титрования) не зависит практически от концентрации в растворе.
П. Метиловый оранжевый – красный рН>4,4 желтый
→
←
рН < 3,0
Смешанные индикаторы – смесь индивидуальных индикаторов или какого-либо индикатора с инертным красителем.
Состав Jnq Окраска форм Jnq (кислотно-щелочная)
I. Метиловый красный Красная-желтая
П. Метиленовый голубой Синяя-синяя
(инертный краситель)
Ш. Смесь 1 и П (1:1) Красно-фиолетовая-зеленая
IV. Бромкрезоловый зеленый Желтая-синяя
V. Смесь 1 и 1V (1:3) Винно-красная- зеленая
Формы компонентов смешанных индикаторов имеют взаимодополняющие цвета, при наложении которых раствор приобретает нейтральный серо-белый цвет, существующий в очень узком интервале концентраций определяемого компонента. Смешанные Jnq имеют контрастный переход. С этими Jnq удобно работать в условиях искусственного освещения, в слабо окрашенных и мутных растворах.
В некоторых случаях целесообразно использовать специфические индикаторы. Они реагируют только со строго определенным веществом с четко выражененым аналитическим эффектом. Например, в J-метрии – крахмал
синяя окраска;
на Fe3+ -роданид-ион NCS- FeNCS2+
кармино-красный цвет
5.По характеру окраски
Основные характеристики индикаторов:
Jnq характеризуются такими параметрами, как интервал перехода эффекта (окраски, свечения, помутнения раствора) и показатель титрования.
Под интервалом перехода понимают интервал концентраций (рХ) фиксируемого вещества, в пределах которого происходит заметное изменение аналитического эффекта. Его обозначают ∆рХJnq.
Значение рХ, при котором наиболее резко заметно изменение аналитического эффекта, называют показателем фильтрования (точкой перехода) Jnq и обозначают рТJnq.
Выбор индикатора
Учитывают.
1. Величину соответствующей фиксируемой характеристики раствора, в частности в точке эквивалентности или в области резкого ее изменения (скачка свойства).
2. Величину интервала перехода или показателя титрования Jnq; предпочтение отдают Jnq с узким интервалом перехода;
3. Цвет и интенсивность разно окрашенных форм индикатора.
6. Возможность участия Jnq в каких-либо реакциях, кроме индикаторной.
Если Jnq выбран правильно, то его рТJnq (показатель титрования) почти совпадает с фиксируемым рХ (интервал концентрации) в точке эквивалентности, окраски разно окрашенных форм достаточно хорошо различаются, не происходит взаимодействия ни одной из форм с компонентами раствора, кроме фиксируемой частицы.
5. СХЕМЫ
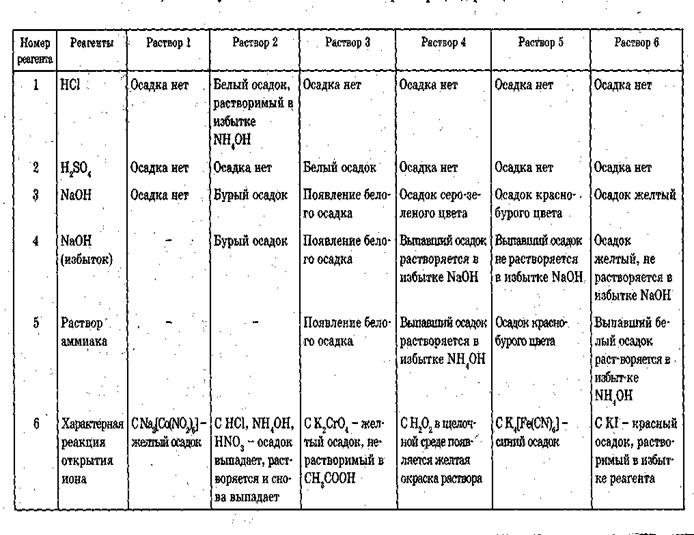
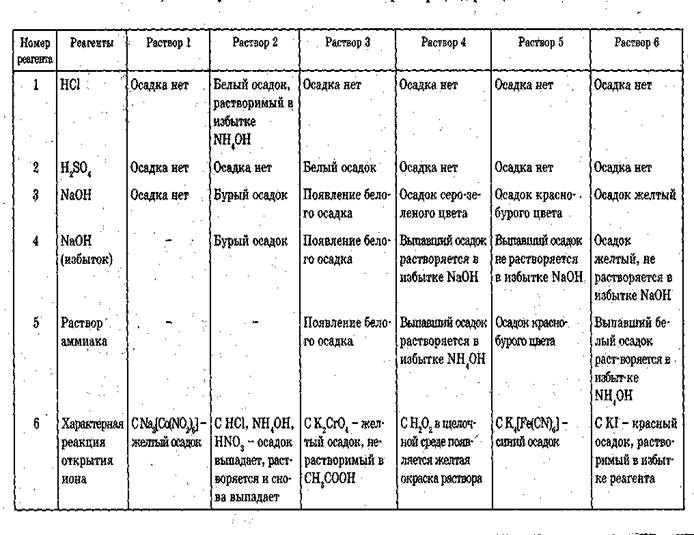
Таблица 1.
Действие групповых реактивов на катионы
|
|
|
|