5 . Условия образования осадков
В процессе растворения твердого вещества в растворе наступает момент, когда число ионов, переходящих в раствор, учитывается с числом ионов, переходящих в осадок. Зная концентрации ионов в растворе, можно прогнозировать направление гетерогенного процесса. Если произведение концентрации ионов, образующих малорастворимый сильный электролит в степенях, равных стехеометрическим коэффициентам, будет больше КS (константы растворимости, ПР) то произойдет образование твердой фазы, т.е. осадка.
BaSO4 → Ba2+ + SO42-
←
Для этого процесса произойдет образование осадка, если [Ba2+] x [SO42-] > KS, так как раствор является не насыщенным, осадка не образуется.
Образование осадка связано с процессом укрупнения частиц, с образованием кристаллической решетки вещества.
Процесс образования осадка имеет три стадии.
- возникновение зародышей кристаллизации;
- рост кристаллов из зародышей;
- агрегация кристаллов с образованием поликристаллического осадка.
Для того, чтобы вызвать возникновение зародышей кристаллизации, потирают внутренние стенки пробирки стеклянной палочкой. Это наблюдается при обнаружении ионов натрия Na+ с помощью гексагидроксостибиата (V) калия K[Sb(OH)6].
Когда произведение [Ba+] x [SO42-] = KS раствор станет насыщенным и выпадение осадка прекратится.
Зная V и концентрацию смешанных растворов, можно определить, будет ли выпадать осадок образующейся соли.
Пример: Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов CaCl2 и NaCO3? KS(CaCO3) = 5.10-9.
После смешивания растворов [ С ] каждого из ионов стала в 2 раза меньше первоначальной, то есть 0,01моль/л, так как во столько же раз уменьшается концентрация каждой соли.
[Ca2+] x [CO32-] = 0.01 x 0.01= 1 x 10-4
Полученное значение больше константы растворимости KSCaCO3 и поэтому осадок образуется. На процесс образования осадка влияют следующие факторы:
- концентрация исходных растворов. [ С ] не должна быть слишком высокой или слишком малой. Не должно произойти значительного перенасыщения раствора, иначе образуется большое число центров кристаллизации и выпадает мелкокристаллический осадок.
- растворимость соединений, образующих осадок. Чем меньше растворимо соединение, тем более полно осаждается ион. Осаждение считается практически полным, когда остаточная концентрация осаждаемого иона в растворе меньше чем на 10-6моль/л,
- Например, ионы Рb2+ могут осаждаться в виде хлоридов, сульфата и сульфида свинца. Растворимость (S) и константа растворимости (КS) имеют следующие значения:
Таблица 2.
Значение S и Ks некоторых солей
| РbCl2 | PbSO4 | PbS | |
| KS | 1,6 х 10-5 | 1,6 х 10-8 | 2,5 х 10-27 |
| S, моль/л | 0,4 х 10-2 | 1,2 6 х 10-4 | 5,0 х 10-14 |
Сравнение величины КS и S показывает, что наиболее растворимым соединением является хлорид свинца, менее растворимым PbS. Осаждение считается практически полным, когда остаточная концентрация осаждаемого иона в растворе меньше, чем 10-6 моль/л. Значит, ионы свинца осаждаются практически полно в виде сульфида свинца. Необходимо принять во внимание большое значение КS(PbCl2), именно этим объясняется неполное отделение ионов Pb2+ от ионов Аq+ и Нg22+ при систематическом ходе анализа с помощью хлороводородной кислоты.
- влияние одноименного иона – понижает растворимость малорастворимых электролитов по закону действующих масс. Например, в процессе осаждения PbSO4 -[(Pb2+) x [SO42-] становится равным KS(PbSO4) и выпадение осадка прекращается. Устанавливается равновесие
KS
PbSO4 → Pb2+ + SO42-
←
Добавление одноименных ионов в виде Na2SO4 или H2SO4 (как осадителей) приводит к более полному осаждению Рb2+ из раствора. Равновесие смещается влево, в сторону образования осадка, так как произведение [Pb2+] x [SO42-] > KS(PbSO4). Но при большом избытке одноименного иона может наблюдаться повышение растворимости осадка и образование кислой соли: PbSO4 + H2SO4 = Pb(HSO4)2.
На практике обычно берут не более чем полуторный избыток осадителя.
- влияние t0. t0увеличивает растворимость солей и KS. Поэтому осаждение из растворов проводят при комнатной температуре.
Осаждение из подогретых растворов – при медленном охлаждении такого раствора происходит постепенный переход осадка из аморфного состояния в кристаллическое, что позволяет предотвратить образование коллоидных растворов.
6. УСЛОВИЯ РАСТВОРЕНИЯ ОСАДКОВ
В насыщенном растворе гетерогенной системы МА → М+ + А-
Растворение осадка или сдвиг равновесия вправо, может быть осуществлено с помощью любого метода и уменьшения концентрации свободных ионов М+ и А- :
- связыванием этих ионов в другой, менее растворимый осадок;
если в растворе присутствуют ионы SO42- и СО32- , то при введении в него ионов Са2+ в осадок прежде всего переходит карбонат кальция СаСО3, так как (СаСО3) < K3(CaSO4). В качественном анализе одним и тем же осадителем можно разделять несколько ионов, зная
значения КS, образующихся соединенно. Это дробное осаждение, но осадки должны легко различаться по внешнему виду (окраска, кристаллы).
Допустим, что имеется осадок сульфата кальция CASO4. Если к раствору с осадком добавить хлорид стронция SrCl2, то сульфат кальция СаSO4 превратится в SrSO4 так как раствор над осадком содержит сульфат – ион SO42-. При добавлении SrCl2 ионы S О42- - образуют молекулы SrSO4, так как сульфат стронция менее растворим (KSSrSO4 = 3,2 х 10-7), чем Са [KSCaSO4 = 1,3 х 10-4], то концентрация сульфат-ионов SO4 достаточна, чтобы превысить KS(SrSO4). Сульфат стронция начнет выпадать в осадок.
В растворе уменьшится концентрация [SO42-]; [Ca2+] x [SO42-] станет меньше КS[CaSO4] и часть осадка СаSO4 перейдет в раствор.
Сульфат-ионы, перешедшие в раствор, свяжутся с Sr2+. Происходит процесс перехода малорастворимого СаSO4 в еще более малорастворимый SrSO4.
KS
CaSO4 == Ca2+ + SO42-
+
Sr2+
↑↓ KS2
SrSO4
Наблюдается два гетерогенных однотипных конкурирующих равновесия. Конкуренцию за общий ион SO4 выигрывает тот ион, который образует малорастворимый электролит с меньшим значением КS (в приведенном примере - ион Sr 2+).
- связывание ионов Ме малорастворимого сильного электролита в комплексное соединение.
Рассмотрим систему
Аq → Аq + + Cl- (I)
→
[Aq(NO3)2]+ → Aq+ + 2 NO3 0 (П)
При пропускании NH3 через насыщенный раствор АqСl (первое гетерогенное равновесие образуется комплексный ион [Aq(NH3)2]+ и возникает новое уже гомогенное равновесие, обусловленное диссоциацией комплексного иона (второе равновесие). В результате образования комплексного иона активность Аq+ в растворе уменьшится, что вызывает растворение осадка AqCl и при дальнейшем добавлении NH3 осадок полностью растворяется.
В систематическом анализе катионов П группы реакцию образования комплексных соединений и затем их разрушения используют при разделении Аq+ и Нg22+.
Схема процесса растворения осадка с образованием комплексного соединения
KS
Ma == M+ + A-
+
nL
↑↓ Kн
[M(L)n]+ , где МА – малорастворимый сильный электролит
L - лиганд
[M(L)n]+ - растворимое комплексное соединение
7. СВЯЗЫВАНИЕ АНИОНА В МАЛОДИССОЦИИРУЕМУЮ
КИСЛОТУ
Растворимость труднорастворимых солей, образованных анионами слабых кислот (СО32-, РО43-, С2О42-), зависит от значения рН раствора, что объясняется конкуренцией за анион между катионами металла и протонами.
КS
CaCO3== Ca2+ + CO32_
1+
2H+
2↑↓ Kq
 СО2
СО2
 H2CO3
H2CO3
H2O
Осадок СаСО3. Раствор, соприкасающийся с осадком СаСО3, является насыщенным относительно этого осадка. [Ca2+] x [CO32_] = KS(CaCO3). При приливании НCl ионы Н+ начинают связывать карбонат-ионы СО32- в молекулы угольной кислоты, которая распадается на СО2 и Н2О. В растворе уменьшается концентрация карбонат-ионов и гетерогенное равновесие 1 сместится в сторону образования новых ионов кальция и карбонат-ионов, т.е. часть осадка переходит в раствор. Возникает гомогенное равновесие 2. При добавлении определенного количе тва кислоты, т.е. при определенном значении рН, может произойти полное растворение осадка САСО3.
Для растворения труднорастворимых электролитов в раствор добавляют такой электролит, ионы которого могут образовать малодиссоциированное соединение с одним из ионов труднорастворимого электролита. Например: Fe(OH)3 + 3HCl → FeCL3 + H2O
Mq(OH)2 + 2NH4Cl → MqCl 2 + 2NH4OH. Растворение гидроксидов Fe(OH)3 и Мq(ОН)2 происходит потому, что ионы ОН- связываются в малодиссоциирующие соединения Н2О и NH4OH. Растворение Мq(ОН)2 в солях аммония используют для разделения ионов Мq2+ и Fe3+.
8. ОКИСЛЕНИЕ ИЛИ ВОССТАНОВЛЕНИЕ КАТИОНА ИЛИ АНИОНА
Растворение осадка может происходить в результате изменения степени окисления какого-либо элемента, входящего в состав твердой фазы, то есть при протекании окислительно-восстановительных процессов. Для осадка со свойствами восстановителя надо подобрать достаточно сильный окислитель и наоборот.
Анион С2О42- труднорастворимого электролита СаС2О4 является восстановителем и для него лучший окислитель – ион МnО4, добавленные в гетерогенную систему 1 в виде раствора перманганата калия.
КS
CaC2O4 == Ca2+ + C2O42-
KМnO4 pH < 7
В этих двух системах ( 1- гетерогенная, 2 гомогенная) идет конкуренция за оксалат – ион С2О42-. Выигрывает ион МnО4-, который окисляет оксалат – ион, и в конечном итоге осадок растворяется, а выделение СО2 быстро смещает равновесие в сторону растворения осадка.
9. СОЛЕВОЙ ЭФФЕКТ
Прибавление в раствор электролита соли с разноименными ионами повышает растворимость электролита.
Например, растворимость сульфата свинца повышается в присутствии нитрата калия
или натрия, а растворимость хлорида серебра повышается в присутствии сульфата натрия
или калия.
Физическая причина солевого эффекта заключается в следующем – большое количество посторонних ионов мешает ионам труднорастворимой соли, находящимся в растворе, сталкиваться друг с другом и с поверхностью осадка. Это ускоряет процесс растворения осадка.
10. КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Укажите значение гетерогенных процессов в медицине и аналитической химии.
2. Напишите выражение концентрационной константы растворимости для карбоната и фосфата кальция.
3. К каким электролитам применяется понятие константы растворимости?
4. В каких случаях происходит: а) выпадение осадка; б) растворение осадка; в) выпадение осадка прекращается.
5. К раствору, содержащему ионы Са2+ и Sr2+ в равных концентрациях, прибавляли по каплям раствор сульфата натрия. Какой из осадков выпадет в первую очередь?
Тема 6. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Содержание:
1. Строение комплексных соединений. Теория вернера.
2. Природа химической связи в комплексных ионах.
3. Классификация и номенклатура комплексных соединений
4. Диссоциация комплексных соединений
5. Применение комплексных соединений в медицине и химическом анализе.
6. Контрольные вопросы и упражнения.
1. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ. ТЕОРИЯ ВЕРНЕРА.
В результате взаимодействия некоторых простых бинарных соединений друг с другом образуются новые, более сложные соединения – комплексные.
4KCN + Fe(CN)2 = K4[Fe(CN)6];
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые
способны существовать в растворе:
К4[Fe(CN)6] → 4K+ +[Fe(CN)6]4-
В водном растворе К4[Fe(CN)6] имеются катионы К+ и анионы [Fe(CN)6]4-, но нельзя обнаружить ионы Fe2+ и CN-. Из этого следует, что они соединились и образовали сложный ион [Fe(CN)6]4-, который называется комплексным. Состав комплексного соединения изображают химической формулой, в которой комплексный ион заключают в квадратные скобки. Образование двойных солей не ведет к существенным изменениям свойств исходных соединений, из которых они образовались.
Первая теория строения комплексных соединений была разработана швейцарским химиком А.Вернером в 1893г. Особый тип валентных сил, на котором основано образование комплексных соединений, был назван Вернером координационной связью, а теория получила название координационной.
Согласно теории Вернера, центральное место в комплексном соединении занимает комплексообразователь, или центральный атом. Комплексообразователями чаще всего являются катионы металлов. Наибольшую склонность к комплексообразованию проявляют ионы d – элементов: Aq+,Cu2+, Co3+, Fe3+, Fe2+ и др. Вокруг центрального атома находятся (или координируются) противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами или аддендами. Комплексообразователь и лиганды образуют внутреннюю координационную сферу комплексного соединения, которая заключается в квадратные скобки. Число лигандов, которое связывается с комплексообразователем, называется координационным числом. Чаще всего они принимают значения 4 6 и зависят от степени окисления центрального атома и природы лиганда.
Таблица 3.
Координационные числа для ионов-комплексообразователей
| Координационное число | Ионы - комплексообразователи |
| 2 4 6 | Cu+, Aq+, Au+ Cu2+, Co2+, Au2+, Zn2+, Pb2+, Pt2, Al3+ Fe2+, Fe3+, Co3+, Ni2+, Al3+, Pt4+, Hb4+, Cr3+ |
В качестве лигандов выступают нейтральные молекулы (Н2О, NH3CO), ионы (NO2-. Cl-, Br-, OH- и др.). Каждый лиганд содержит определенное число атомов (донорных атомов), которые участвуют в непосредственном связывании с центральным атомом и образуют определенное число координационных связей (дентатность). Если лиганд образует одну связь с центральным атомом, то это монодентатный лиганд.К монодентатным лигандам относятся Сl-, J-, Br-, CN-, OH- и др. В случае монодентатных лигандов координационное число равно числу лигандов.
Бидентатный лиганд содержит два атома, которые образуют связь с центральным атомом. Например, этилендиамин (en) H2N – CH2 – CH2 – NH2 является бидентатным лигандом, в молекуле которого каждый из двух атомов азота образует одну связь с центральным атомом. В комплексном ионе [Cu(en)3]2+ координационное число меди равно 6, то есть в случае би- и полидентатных лигандов координационное число равно числу лигандов умноженному на дентатность К полидентатным лигандам относятся аминокислоты, белки пептиды, порфирины, которые называются еще биолигандами.
Заряд комплексного иона равен алгебраической сумме зарядов иона- комплексообразователя и лигандов:
Aq+ + 2 CN - 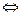
 [Aq(CN)2]- ; (+1 – 2= -1)
[Aq(CN)2]- ; (+1 – 2= -1)
Pt4+ + 6 Cl 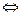 [PtCL6]2-. (+4 – 6= -2)
[PtCL6]2-. (+4 – 6= -2)
Входящие в состав комплексного иона электронейтральные молекулы не влияют на величину его заряда. Если лигандами являются только электронейтральные молекулы, то заряд комплексного иона равен заряду комплексообразователя. Например, в комплексных ионах [Aq(NH3)2]+ и [Cu(NH3)4]2+ заряд ионов равен заряду комплексообразователя.
Ионы, не вошедшие во внутреннюю координационную сферу. Образуют внешнюю координационную сферу. Ионами внешней сферы часто являются ионы щелочных и щелочноземельных металлов, ионы аммония и анионы.
2. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ
В КОМПЛЕКСНЫХ ИОНАХ
Для объяснения образования, строения и свойств комплексных соединений применяются
Различные теории, но наиболее наглядным и доступным является метод валентных связей (МВС)
Согласно МВС, в процессе образования комплексного иона устанавливается прочная связь между
комплекснообразователем и лигандами.
Механизм образования комплексного иона [Zn(NH3)4]2+.

 Атом азота в молекуле аммиака имеет неподеленную пару электронов, а ион Zn2+ имеет четыре свободные орбитали. Поэтому при образовании комплексного иона [Zn(NH3)4]2+ роль донора играют четыре молекулы аммиака, а роль акцептора – ион цинка Zn2+, который принимает четыре пары электронов от четырех молекул аммиака. В образовании связи участвуют одна 4s-орбиталь и три 4р-орбитали иона цинка. Комплексный ион [Zn(NH3)4]2+ имеет геометрическую конфигурацию (тетраэдр), что означает осуществление sp3- гибридизации. Образование комплексного иона [Zn(NH3)4]2+может быть показано и следующим образом:
Атом азота в молекуле аммиака имеет неподеленную пару электронов, а ион Zn2+ имеет четыре свободные орбитали. Поэтому при образовании комплексного иона [Zn(NH3)4]2+ роль донора играют четыре молекулы аммиака, а роль акцептора – ион цинка Zn2+, который принимает четыре пары электронов от четырех молекул аммиака. В образовании связи участвуют одна 4s-орбиталь и три 4р-орбитали иона цинка. Комплексный ион [Zn(NH3)4]2+ имеет геометрическую конфигурацию (тетраэдр), что означает осуществление sp3- гибридизации. Образование комплексного иона [Zn(NH3)4]2+может быть показано и следующим образом:
NH3 2+
↓
Zn2+ + 4NH3 → H3N → Zn ← NH3
↑
NH3
Таким образом, с помощью МВС можно объяснить определенные значения координационных чисел комплексных ионов. С позиций этого метода хорошо объясняются и магнитные свойства комплексных соединений, но с его помощью нельзя объяснить их оптические свойства: цвет и спектры поглощаются. Для объяснения других физических и химических свойств комплексных соединений применяется теория кристаллического поля и метод молекулярных орбиталей.
3. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА








