Методы изучения генетики микроорганизмов
Выявление фенотипической изменчивости (модификации)
Изучают колонии Proteus mirabilis, выросшие на питательном агаре в чашке Петри через 24 ч после посева разведенной культуры. Отмечают, что все колонии протея окружены зоной роения. Пересевают все колонии петлей на поверхность питательного агара с 1% сухой желчью в чашки Петри и инкубируют при 37°С 18-24 ч. Все колонии протея, выросшие на питательном агаре с желчью, не имеют зон роения. Вновь пересевают каждую колонию в чашку Петри с питательным агаром и инкубируют при 37°С 18-24 ч. Наблюдают, что все колонии, выросшие на питательном агаре, окружены зоной роения.
Изменение фенотипа протея на питательной среде с желчью (утрату роения) следует считать модификацией, т.к. налицо все три ее отличительных признака:
· определенность (связь отсутствия роения с определенным фактором - желчью),
· общность изменений (утрата роения наблюдается у всех изученных клеток или колоний популяции),
· обратимость (при отсутствии желчи в питательной среде восстанавливается исходный фенотип).
Выявление мутантов-бактерий и доказательство спонтанности мутаций тестом перераспределения
В две чашки Петри с питательным агаром вносят по 0,1 мл суточной бульонной культуры E.coli М-17 (посевная доза 1х108 бактерий) и равномерно распределяют шпателем по поверхности питательной среды. Через 6 ч инкубации при 37°С в одной из чашек перераспределяют шпателем популяцию бактерий (микроколонии) по поверхности питательной среды, а другую чашку оставляют нетронутой. Выросшие через 24 ч бактерии пересевают из каждой чашки методом отпечатков с помощью штампа-репликатора на поверхность питательного агара с рифампицином (100 мкг/мл) в отдельные чашки Петри и инкубируют при 37°С. Через 24 ч учитывают результат:
· на поверхности среды с рифампицином в чашке без перераспределения выросли единичные колонии рифампицинрезистентных мутантов,
· в чашке с перераспределением посевов выросли более многочисленные (в десятки - сотни раз) колонии антибиотикоустойчивых мутантов.
Перераспределение бактерий шпателем на поверхности питательной среды без антибиотика не оказывает влияния на число бактерий. Если допустить, что антибиотикоустойчивые мутанты возникают в результате индукции антибиотиком, то после перераспределения и без него на питательной среде с антибиотиком должно вырасти одинаковое число колоний антибиотикоустойчивых мутантов. Если же антибиотикоустойчивые мутанты возникают спонтанно и в отсутствии антибиотика, то результат будет иной. Уже в первой инкубации (через 6 ч) на среде без антибиотика на чашках появляются микроколонии антибиотикоустойчивых клеток-мутантов. Благодаря перераспределению бактерии-мутанты из этих микроколоний распространяются по всей поверхности среды и после посева отпечатками на среду с антибиотиками дадут начало многочисленным колониям мутантов, в то время как отпечатки с чашки без перераспределения выявляют только небольшое число колоний, соответственно исходным микроколониям мутантов. Полученный в данном опыте результат доказывает, что антибиотикоустойчивые мутанты возникли спонтанно до контакта бактерий с селективным агентом рифампицином.
Постановка опыта конъюгации
Донор: E.coli К-12 HfrC Leu+ Thr+ Sms Реципиент: E. coli C-600 Leu- Thr- Smr. Селективная среда для выделения рекомбинантов: максимальная среда, содержащая NH4Cl - 5 г, NH4NO3 -1 г, Na2SO4 - 2 г, К2НРО4 - 3 г, KH 2 PO 4 - 1 r, MgSO4x7H20 - 0,1 г, глюкозу - 2 г, агар-агар -15 г, дистиллированную воду до 1 л, стрептомицин 200 ЕД/мл.
К 4,5 мл суточной бульонной культуры реципиента добавляют 0,5 мл суточной бульонной культуры донора и инкубируют при 37°С в течение 1 ч. Затем делают разведения смеси физиологическим раствором от 10-1 до 10-5 и высевают по 0,1 мл на селективную среду в чашки Петри (на среде могут вырасти только колонии бактерий рекомбинантов, ставших прототрофами в результате получения генов Leu и Thr донора). В качестве контроля на ту же среду засевают раздельно по 0,1 мл культуры донора и реципиента. Они не должны расти на селективной среде, т.к. доноры чувствительны к стрептомицину, а реципиенты - ауксотрофы по лейцину и треонину. Для определения числа жизнеспособных клеток донора разводят его культуру физиологическим раствором и высевают из разведении l0-6-l0-7 по 0,1 мл на селективную среду без стрептомицина. Все посевы инкубируют при 37°С 24-48 ч.
После подсчета выросших колоний определяют частоту рекомбинаций по отношению числа рекомбинантов к числу донорских клеток. Например, после посева 0,1 мл смеси в разведении 10-4 на селективной среде выросло 150 колоний рекомбинантов, а после посева 0,1 мл культуры донора в разведении 10-6 выросло 75 колоний. Следовательно, частота рекомбинантов будет:
1,5х107 / 7,5 108=2х10-2.
Выявление конъюгативных R-плазмид
Испытуемые бактерии: клинические штаммы антибиотикорезистентных шигелл Зонне. Реципиент: штамм E. coli W 1655 Tra- Lac+ Nlr сохранивший видовую чувствительность к антибиотикам и имеющий нетрансмиссивную хромосомную устойчивость к налидиксовой кислоте. Питательная среда для определения детерминант приобретенной антибиотикоустойчивости: среда Эндо, содержащая раздельно антибиотики - тетрациклин (64 ЕД/мл), левомицетин (64 мкг/мл), стрептомицин (128 ЕД/мл), канамицин (128 ЕД/мл), ампициллин (256 ЕД/мл). Селективная среда для выделения антибиотикоустойчивых рекомбинантов - указанная среда с антибиотиками, содержащая дополнительно к каждому антибиотику налидиксовую кислоту (64 мкг/мл).
Для выявления детерминант антибиотикоустойчивости засевают петлей суточные бульонные культуры щигелл Зонне на секторы сред Эндо с различными антибиотиками и без антибиотиков (контроль).
На каждую чашку делают посев 4-12 штаммов путем нанесения одной петли культуры радиальным штрихом. С целью изучения трансмиссивности детерминант антибиотикоустойчивости путем конъюгации вносят по 0,5 мл тех же культур Зонне (доноры) в пробирки с 4 мл бульона Хоттингера и добавляют в каждую пробирку по 0,5 мл суточной бульонной культуры эшерихий (реципиента), т.е. для каждого штамма шигелл используют одну пробирку. Посевы инкубируют при 37°С.
Через 24 ч учитывают антибиотикорезистограммы. Шигеллы Зонне имеют детерминанты приобретенной антибиотикоустойчивости к тем антибиотикам, на средах с которыми выросли сплошным газоном или отдельными колониями по ходу посева, и чувствительны к тем антибиотикам, на средах с которыми роста нет. В это же время делают высев из пробирок с конъюгационной смесью бактерий на секторы селективных сред для выделения антибиотикоустойчивых рекомбинантов. Высев из смеси делают конкретно для каждого штамма шигелл только на селективные среды с теми антибиотиками, устойчивость к которым обнаружена при определении детерминант антибиотикорезистентности. Методика посева на секторы сред идентична уже описанной. Чашки с посевами инкубируют при 37°С 24 ч, после чего учитывают результаты. Шигеллы Зонне имеют трансмиссивные детерминанты устойчивости к тем антибиотикам, на селективных средах с которыми вырастают газонами или отдельными колониями темно-красного цвета рекомбинанты кишечной палочки. Отсутствие роста рекомбинантов на селективных средах с антибиотиками свидетельствует о нетрансмиссивности детерминант устойчивости к этим антибиотикам. Конъюгативная трансмиссивность комплекса детерминант антибиотикоустойчивости с большой вероятностью указывает на их принадлежность к конъюгативной R-плазмиде.
Выявление Col-плазмид
Исследование проводят методом отсроченного антагонизма по Фредерику. Испытуемые культуры (например шигеллы Зонне) засевают уколом в 1,5% мясо-пептонный агар по 4-5 штаммов на одну чашку Петри. После инкубирования в течение 24 ч при 37°С выросшие макроколонии стерилизуют парами хлороформа. С этой целью чашку размещают вверх дном и на внутреннюю поверхность крышки наносят 4-6 капель хлороформа. Через 30 мин хлороформ удаляют, выдерживая чашки с открытой крышкой 15-20 мин. Затем поверхность агара заливают слоем расплавленного и охлажденного до 48°С 0.7% мясо-пептонного агара (5 мл), предварительно смешанного 0,1 мл шестичасовой бульонной культуры индикаторного штамма (например E.coli W1655). После суточной инкубации при 37°С учитывают результат. Бактерии имеют Col-плазмиду (продуцируют колицин), если вокруг их макроколоний образовались зоны подавления роста индикаторной культуры на фоне ее роста сплошным газоном в остальных участках среды. Идентификацию вида Col-плазмид осуществляют этим же методом, используя коллекцию эталонных индикаторных культур с известной резистентностью или чувствительностью к колицинам.
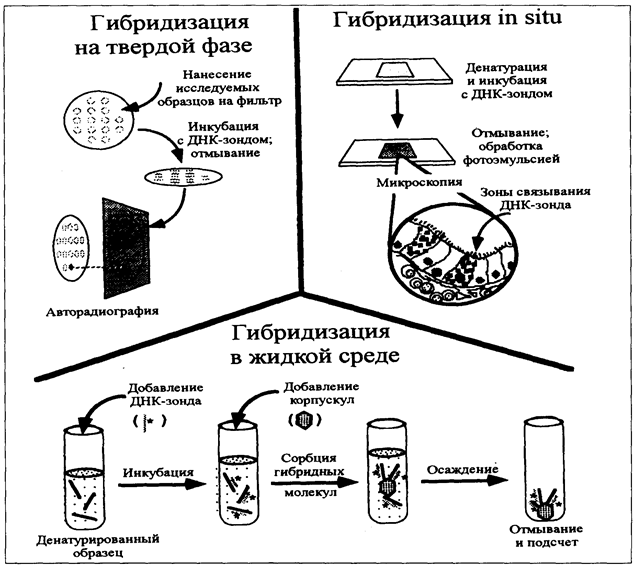
Рис. 1. Выявление генетических маркеров в реакции гибридизации нуклеиновых кислот. Для простоты показаны лишь тесты с радиоактивномеченым ДНК-зондом; возможность других меток предполагается (см. текст). В фильтрационном тесте образцы ДНК денатурируют и наносят на мембрану. После инкубации с ДНК-зондом положительные образцы выявляют путем авторадиографии. При гибридизации in situ манипуляции с ДНК проводят в интактных образцах ткани, фиксируемых на предметном стекле. После инкубации с ДНК-зондом на стекло наносят фотографическую эмульсию. В зонах радиоактивной эмиссиии (т.е. там, где произошла гибридизация) на ней проявляются темные микроскопические гранулы. При гибридизации в растворе смесь ДНК-зонда и денатурированного образца инкубируют в жидкой среде. После гибридизации двухспиральные молекулы-гибриды осаждают из раствора на специальных корпускулах и отмывают от несвязанного ДНК-зонда. Присутствие в пробе ДНК-фрагмента с искомой последовательностью выявляют по радиоактивности осадка [Schaechter M., Medoff G., Eisenstein B.I. (eds.). Mechanisms of Microbial Disease. Williams &Wilkins, 1993]
|
|
|
|

|














|












|



























|
|








 СХЕМА ПЦР
СХЕМА ПЦР








