Процесс установления внутри фаз равновесного распределения концентрации газовых молекул (а также молекул жидких и твёрдых тел) называется диффузией.
Теплопроводность газов — явление направленного переноса тепловой энергии за счет столкновения частиц газа без переноса вещества.
Явление теплопроводности описывается законом Фурье:
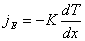 , где
, где
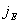 — плотность теплового потока, равная тепловой энергии, переносимой за единицу времени через единичную площадку, перпендикулярную оси x.
— плотность теплового потока, равная тепловой энергии, переносимой за единицу времени через единичную площадку, перпендикулярную оси x.
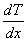 — градиент температуры,
— градиент температуры,
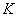 — коэффициент теплопроводности.
— коэффициент теплопроводности.
Вязкость газов (явление внутреннего трения) — это появление сил трения между слоями газа, движущимися друг относительно друга параллельно и с разными по величине скоростями.
В кинетической теории газов коэффициент внутреннего трения вычисляется по формуле
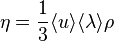 ,
,
где 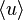 — средняя скорость теплового движения молекул,
— средняя скорость теплового движения молекул, 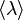 − средняя длина свободного пробега.
− средняя длина свободного пробега.
Формула внутренней энергии идеального газа:
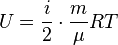 ,
,
и прямо связанная с ней формула для средней энергии молекулы идеального газа
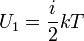 ,
,
где
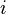 — количество степеней свободы молекулы газа,
— количество степеней свободы молекулы газа,
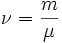 — количество газа (
— количество газа ( 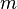 — масса,
— масса, 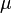 — молярная масса газа),
— молярная масса газа),
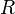 — универсальная газовая постоянная,
— универсальная газовая постоянная,
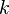 — константа Больцмана,
— константа Больцмана,
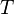 — абсолютная температура газа,
— абсолютная температура газа,
— включают количество степеней свободы молекулы.
Уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов)
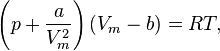
где
· 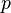 — давление,
— давление,
· 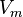 — молярный объём,
— молярный объём,
· 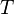 — абсолютная температура,
— абсолютная температура,
· 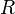 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п.
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
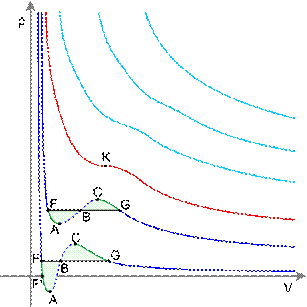

Изотермы реального газа (схематично)
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — равновесие жидкой и газообразной фазы.
Участок FA — перегретая жидкость.
Участок F′A — растянутая жидкость (p<0).
Участок AC — аналитическое продолжение изотермы, физически невозможен.
Участок CG — переохлаждённый пар.
Точка G — точка росы.
Участок правее точки G — нормальный газ.
Площади фигуры FAB и GCB равны.
Красная — критическая изотерма.
K — критическая точка.
Голубые — сверхкритические изотермы
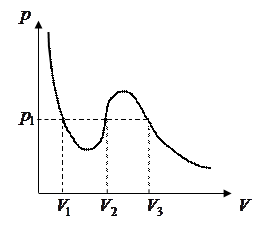
Изотерма Ван-дер-Ваальса - давлению 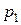 соответствуют три значения молярного объёма
соответствуют три значения молярного объёма 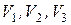 . Минимальный объём
. Минимальный объём 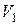 (максимальная плотность) соответствует жидкому состоянию, максимальный объём
(максимальная плотность) соответствует жидкому состоянию, максимальный объём 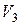 – газообразному состоянию.
– газообразному состоянию.
Внутренняя энергия реального газа будет определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп:
U=Eк+Eп.








