Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона. Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона.
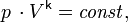
где 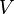 — его объём,
— его объём, 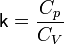 — показатель адиабаты,
— показатель адиабаты, 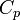 и
и 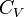 — теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
КПД тепловой машины = A/Q x 100%
где А - работа совершенная тепловой машиной,
Q - затраченное тепло
Холодильный коэффициент
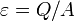 ,
,
где 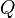 — тепло, отбираемое от холодного конца (в холодильных машинах) или передаваемое к горячему (в тепловых насосах);
— тепло, отбираемое от холодного конца (в холодильных машинах) или передаваемое к горячему (в тепловых насосах); 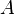 — затрачиваемая на этот процесс работа (или электроэнергия). Наилучшими показателями производительности для таких машин обладает обратный цикл Карно
— затрачиваемая на этот процесс работа (или электроэнергия). Наилучшими показателями производительности для таких машин обладает обратный цикл Карно
Вну́тренняя эне́ргия термодинамической системы (обозначается как E или U) — это сумма энергий теплового движения молекул и межмолекулярных взаимодействий.
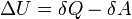
где
· 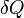 — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях
· 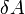 — работа, совершаемая телом против внешних сил, измеренная в джоулях
— работа, совершаемая телом против внешних сил, измеренная в джоулях
свобо́дная эне́ргия — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами. Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
· 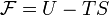 , где
, где 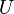 — внутренняя энергия,
— внутренняя энергия, 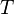 — абсолютная температура,
— абсолютная температура, 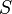 — энтропия.
— энтропия.
Энтропия - мера хаотичности, неупорядоченности системы
Термодинамическая энтропия S является функцией состояния термодинамической системы.
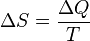
Энтальпи́я— термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
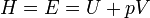
2 закон термодинамики.
Впервые его сформулировал Клаузиус: "теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении".
- все самопроизвольные процессы в природе идут с увеличением энтропии
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, возникшая в XIX веке и рассматривающая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
· все тела состоят из частиц: атомов, молекул и ионов;
· частицы находятся в непрерывном хаотическом движении (тепловом);
· частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
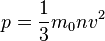 Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).








