Основные правила работы в лабораторном практикуме
1. К учебным занятиям в химической лаборатории практикума физической и коллоидной химии допускаются лица, прошедшие инструктаж по технике безопасности при выполнении работ лабораторного практикума.
2. Студенты и другие обучаемые лица перед началом занятий размещаются в учебных лабораториях. Нахождение их в неучебных помещениях без разрешения преподавателя или сотрудника кафедры не допускается.
3. До начала занятий не разрешается приступать к выполнению лабораторных работ, брать и переставлять реактивы и химическую посуду на столах, включать приборы и оборудование. К работе приступать только после начала занятий и с разрешения преподавателя или лаборанта. Не приступать к работе без уяснения всех требований техники безопасности.
4. В ходе учебных занятий строго придерживаться порядка и метода выполнения работы согласно имеющихся требований. Разрешается пользоваться реактивами и посудой, предназначенными только для выполнения данной работы. Не брать реактивы и химическую посуду с других столов. При отсутствии требуемого реактива обращаться к лаборанту или преподавателю.
5. Категорически запрещается проводить в лаборатории какие-либо работы, не связанные с выполнением полученного задания.
6. Во время занятий в лаборатории необходимо соблюдать чистоту, тишину, выполнять требования техники безопасности. Запрещается посторонним лицам посещать студентов, работающих в лаборатории и отвлекать их.
7. Запрещается при работе пробовать на вкус и нюхать химические реактивы и растворы. Не пить в лаборатории воду и не принимать пищу.
8. Соблюдайте осторожность при выполнении работ. Не допускайте попадания реактивов на слизистые оболочки рта, носа и глаз. При попадании реактивов на слизистые оболочки немедленно сообщите об этом преподавателю.
9. Экономьте газ, электричество, воду, реактивы. Не превышайте установленных норм расхода реактивов.
10. Растворы солей серебра, меди сливайте в специальную посуду.
11. При неиспрпавности электропроводки, газовой или водопроводной сети, лабораторной посуды, приборов и оборудования немедленно сообщите об этом лаборанту или преподавателю.
12. Бережно обращайтесь с посудой и оборудованием.
13. По окончании работы необходимо убрать рабочее место и сдать его лаборанту.
14. Лица, нарушающие правила техники безопасности при проведении работ лабораторного практикума, отстраняются от занятий и вновь допускаются только после повторного инструктажа.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Алёшин С.Н. Руководство к практическим занятиям по физической и коллоидной химии (учебное пособие). М.: Изд-во ТСХА, 1952.
2. Болдырев А.И. Физическая и коллоидная химия. М.: Изд-во Высшая школа, 1983.
3. Хмельницкий Р.А. Физическая и коллоидная химия. М.: Изд-во Высшая школа, 1988. 400 с.
4. Горшков В.И., Кузнецов И.А. Основы физической химии. 3-е изд. М.: БИНОМ. Лаборатория знаний, 2006. 407 с.
5. Равич-Щербо М.И., Анненков Г.А. Физическая и коллоидная химия. М.: Изд-во Высшая школа, 1968.
6. Руцков А.П. Краткий курс коллоидной химии. Л.: ГОСХИМИЗДАТ, 1958.
7. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. 4-е изд., испр. и доп. Л.: Химия, Ленинградское отделение, 1976. 376 с.
8. Барковский В.Ф., Ганопольский В.И. Дифференциальный спектрофотометрический анализ. М.: Химия, 1969. 165 с.
9. Крешков А.П. Основы аналитической химии. М.: Химия, 1977. Ч.2. Ч.3.
10. Бабко А.К., Пилипенко А.Т., Пятницкий И.В., Рябушко О.П. Физико-химические методы анализа. М.: Высшая школа, 1968.
ПРИЛОЖЕНИЕ
Физические константы:
Число Авогадро – число частиц в 1 Моле вещества: N А = 6,0220*1023 моль -1.
Число Фарадея F = 96485 Кл*моль-1.
Постоянная Больцмана: k = 1,3807*10-23 Дж*град-1.
Постоянная Планка h = 6,626*10-34 Дж*с
Газовая постоянная R = N*k
R = 8,3144 Дж*град-1
= 1,9872 кал*град-1*моль-1
= 0,08206 л*атм*град-1*моль-1
При 25оС R * T = 2,479 кДж*моль-1
Объем 1 моля идеального газа при нормальных условиях (Т=273,15оК и давлении 101,325 кПа) Vo = 22,41*10-3 м3*моль-1
Vo = 22,41 литра
Таблица 1
Единицы измерения
| Название величины и ее обозначение | Единицы измерения | Сокращенное обозначение, размерность | Коэффициенты для приведения к единицам СИ |
| Длина, l | метр | м | - |
| дециметр | дм | 1 дм = 10-1 м | |
| сантиметр | см | 1 см = 10-2 м | |
| миллиметр | мм | 1 мм = 10-3 м | |
| микрон | мк | 1 мк = 10-6 м | |
| миллимикрон ( нанометр) | ммк нм | 1 ммк = 1 нм = 10-9 м | |
| ангстрем | Ао | Ао = 10-10 м | |
| Площадь, S | квадратный метр | м2 | 1 м2 = 100 см2 = 106 мм2 |
| Объем, V | кубический метр | м3 | 1 м3 = 1000 л |
| литр | л | 1 л = 1000 мл = 10-3 м3 | |
| миллилитр | мл | 1 мл = 1 см3 = 10-6 м3 | |
| Время, t | секунда | сек | - |
| минута | мин | 1 мин = 60 сек | |
| час | час | 1 час = 60 мин = 3600 сек | |
| Скорость линейная, v, u | метр в секунду | м/сек | 1 см/сек = 10-2 м/сек |
| километр в час | км/час | 1 км/час = 0,278 м/сек | |
| Коэффициент диффузии, D | квадратный метр в секунду | м2/сек | - |
| Масса, m | килограмм | кг | - |
| грамм | г | 1 г = 10-3 кг | |
| миллиграмм | мг | 1 мг = 10-3 г = 10-6 кг | |
| тонна | т | 1 т =1000 кг | |
| Химическая масса, М | киломоль | кмоль | - |
| моль | моль | 1 моль = 10-3 кмоль | |
| Адсорбция, Г | киломоль на квадратный метр | кмоль/м2 | - |
| моль на квадратный метр | моль/м2 | 1 моль/м2 = 10-3 кмоль/м2 | |
| киломоль на килограмм | кмоль/кг | 1 моль/г = 1 моль/кг | |
| Плотность, d, ρ (D) | килограмм на кубический метр | кг/м3 | 1 г/см3 = 103 кг/м3 |
| Сила, F | ньютон | н | 1 Н= 1 кг*м/сек2 1 Н = 105 дин |
| Коэффициент поверхностного натяжения, σ | ньютон на метр (кг/сек2) | н/м | 1 н/м = 103 дин/см = 103 эрг/см2 1 н/м = 1 дж/м2 |
| Вязкость динамическая, ŋ | ньютон*сек/м2 | н*сек/м2 (кг/м*сек) | 1 пуаз = 0,1 н*сек/м2 |
| Давление, р | ньютон на квадратный метр | н/м2 (кг/м*сек2) | 1 н/м2 = 0,102 мм вод. ст. 1 атм = 1,013*105 н/м2 |
| Давление осмотическое, π | ньютон на квадратный метр | н/м2 (кг/м*сек2) | 1 мм рт. ст. = 1,333*102 н/м2 |
| Работа А, Энергия W , E | джоуль (н*м) | Дж (кг*м2/сек2) | 1 дж = 107 эрг |
| Теплота, Внутренняя энергия, Энтальрия, Термодинамические потенциалы Q , U , q | джоуль (н*м) | Дж (кг*м2/сек2) | 1 кал = 4,19 дж |
| Количество электричества, q | кулон (а*сек) | к | - |
| Напряжение электрическое, U, φ | вольт (дж/к) | в | - |
| Сопротивление элетрическое R | ом (в/а) | ом | - |
| Сопротивление удельное, ρ | ом-метр | ом*м | - |
| Электрическая проводимость, G | сименс | сим (ом-1) | - |
| Удельная электрическая проводимость (электропроводность), | сименс на метр | сим/м | - |
| Удельная электропроводность раствора, ϰ | Электропроводность 1 м3 раствора, помещенного между двумя параллельными электродами, расстояние между которыми 1 м | ом-1*м-1 | - |
| Абсолютная скорость ионов, u | квадратный метр на вольт-секунду | м2*в-1*сек-1 | - |
| Подвижность ионов, l | сименс на квадратный метр на килограмм эквивалент | сим*м2/кг-экв | - |
| Молярность, СМ | число киломолей в 1 м3 раствора | кмоль/м3 | 1 моль/л = 1 кмоль/м3 |
| Моляльность, Смолял | число киломолей в 1000 кг растворителя | кмоль/кг | 1 моль/1000г = 1 кмоль/1000кг |
| Нормальность, Сн | число килограмм-эквивалентов в 1 м3 раствора | кг-экв/м3 | - |
| Таблица 2. Физические свойства воды при разной температуре | ||||
| Т,оС | Плотность d , г/см3 | Упругость пара р, н/м2 | Поверхностное натяжение σ, дж/м2 | Вязкость ŋ, 10-3 м•сек/м2 |
| 15 | 0,9991 | 1705 | 0,07348 | 1,1404 |
| 16 | 0,9989 | 1817 | 0,07334 | 1,1111 |
| 17 | 0,9988 | 1937 | 0,07320 | 1,0828 |
| 18 | 0,9986 | 2064 | 0,07305 | 1,0559 |
| 19 | 0,9984 | 2197 | 0, 07289 | 1,0299 |
| 20 | 0,9982 | 2338 | 0,07275 | 1,0050 |
| 21 | 0,9980 | 2486 | 0,07260 | 0,9810 |
| 22 | 0,9978 | 2644 | 0,07244 | 0,9579 |
| 23 | 0,9975 | 2809 | 0,07228 | 0,9358 |
| 24 | 0,9973 | 2984 | 0,07212 | 0,9142 |
| 25 | 0,9970 | 3168 | 0,07196 | 0,8937 |
| 26 | 0,9968 | 3361 | 0,07180 | 0,8737 |
| 27 | 0,9965 | 3565 | 0,07164 | 0,8545 |
| 28 | 0,9962 | 3780 | 0,07147 | 0,8360 |
| 29 | 0,9959 | 4005 | 0,07131 | 0,8180 |
| 30 | 0,9956 | 4242 | 0,07115 | 0,8007 |
Таблица 3. Растворимость кислот, солей и оснований в воде
| Катион | Анион | ||||||||||||
| ОН- | F- | Cl- | Br- | I- | S2- | SO32- | SO42- | NO3- | PO43- | CO32- | SiO32- | CH3COO- | |
| NH4+ | - | Р | Р | Р | Р | - | Р | Р | Р | Р | Р | - | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Р |
| Mg2+ | М | Н | Р | Р | Р | Р | Н | Р | Р | Н | Н | Н | Р |
| Ca2+ | М | Н | Р | Р | Р | М | Н | М | Р | Н | Н | Н | Р |
| Ba2+ | Р | М | Р | Р | Р | Р | Н | Н | Р | Н | - | Н | Р |
| Al3+ | Н | М | Р | Р | Р | - | - | Р | Р | Н | - | Н | М |
| Cr3+ | Н | Н | Р | Р | Р | - | - | Р | Р | Н | Н | Н | Р |
| Zn2+ | Н | М | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Mn2+ | Р | М | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Co2+ | Н | Р | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Ni2+ | Р | Р | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Fe2+ | Н | Н | Р | Р | Р | Н | - | Р | Р | Н | Н | Н | Р |
| Fe3+ | Н | Н | Р | Р | Р | - | Н | Р | Р | Н | Н | Н | Р |
| Cd2+ | Н | Р | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Hg2+ | - | - | Р | М | Н | Н | Н | Р | Р | Н | Н | - | Р |
| Cu2+ | Н | Н | Р | Р | Р | Н | Н | Р | Р | Н | Н | Н | Р |
| Ag+ | - | Р | Р | Н | Н | Н | Н | М | Р | Н | Н | Н | Р |
| Sn2+ | Н | Р | Р | Р | Р | Н | - | Р | - | Н | - | - | Р |
| Pb2+ | Н | Н | М | М | Н | Н | Н | Н | Р | Н | Н | Н | Р |
Таблица 4. Распределение электронов по энергетическим уровням
в атомах
| 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 5 | 6 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||
| H | 1 | Rb | 2 | 8 | 18 | 8 | 1 | Ta | 2 | 8 | 18 | 32 | 11 | 2 | |||||
| He | 2 | Sr | 2 | 8 | 18 | 8 | 2 | W | 2 | 8 | 18 | 32 | 12 | 2 | |||||
| Li | 2 | 1 | Y | 2 | 8 | 18 | 9 | 2 | Re | 2 | 8 | 18 | 32 | 13 | 2 | ||||
| Be | 2 | 2 | Zr | 2 | 8 | 18 | 10 | 2 | Os | 2 | 8 | 18 | 32 | 14 | 2 | ||||
| B | 2 | 3 | Nb | 2 | 8 | 18 | 12 | 1 | Ir | 2 | 8 | 18 | 32 | 15 | 2 | ||||
| C | 2 | 4 | Mo | 2 | 8 | 18 | 13 | 1 | Pt | 2 | 8 | 18 | 32 | 17 | 1 | ||||
| N | 2 | 5 | Tc | 2 | 8 | 18 | 13 | 2 | Au | 2 | 8 | 18 | 32 | 18 | 1 | ||||
| O | 2 | 6 | Ru | 2 | 8 | 18 | 15 | 1 | Hg | 2 | 8 | 18 | 32 | 18 | 2 | ||||
| F | 2 | 7 | Rh | 2 | 8 | 18 | 16 | 1 | Tl | 2 | 8 | 18 | 32 | 18 | 3 | ||||
| Ne | 2 | 8 | Pd | 2 | 8 | 18 | 18 | 0 | Pb | 2 | 8 | 18 | 32 | 18 | 4 | ||||
| Na | 2 | 8 | 1 | Ag | 2 | 8 | 18 | 18 | 1 | Bi | 2 | 8 | 18 | 32 | 18 | 5 | |||
| Mg | 2 | 8 | 2 | Cd | 2 | 8 | 18 | 18 | 2 | Po | 2 | 8 | 18 | 32 | 18 | 6 | |||
| Al | 2 | 8 | 3 | In | 2 | 8 | 18 | 18 | 3 | At | 2 | 8 | 18 | 32 | 18 | 7 | |||
| Si | 2 | 8 | 4 | Sn | 2 | 8 | 18 | 18 | 4 | Rn | 2 | 8 | 18 | 32 | 18 | 8 | |||
| P | 2 | 8 | 5 | Sb | 2 | 8 | 18 | 18 | 5 | Fr | 2 | 8 | 18 | 32 | 18 | 8 | 1 | ||
| S | 2 | 8 | 6 | Te | 2 | 8 | 18 | 18 | 6 | Ra | 2 | 8 | 18 | 32 | 18 | 8 | 2 | ||
| Cl | 2 | 8 | 7 | I | 2 | 8 | 18 | 18 | 7 | Ac | 2 | 8 | 18 | 32 | 18 | 9 | 2 | ||
| Ar | 2 | 8 | 8 | Xe | 2 | 8 | 18 | 18 | 8 | Th | 2 | 8 | 18 | 32 | 18 | 10 | 2 | ||
| K | 2 | 8 | 8 | 1 | Cs | 2 | 8 | 18 | 18 | 8 | 1 | Pa | 2 | 8 | 18 | 32 | 20 | 9 | 2 |
| Ca | 2 | 8 | 8 | 2 | Ba | 2 | 8 | 18 | 18 | 8 | 2 | U | 2 | 8 | 18 | 32 | 21 | 9 | 2 |
| Sc | 2 | 8 | 9 | 2 | La | 2 | 8 | 18 | 18 | 9 | 2 | Np | 2 | 8 | 18 | 32 | 23 | 8 | 2 |
| Ti | 2 | 8 | 10 | 2 | Ce | 2 | 8 | 18 | 20 | 8 | 2 | Pu | 2 | 8 | 18 | 32 | 24 | 8 | 2 |
| V | 2 | 8 | 11 | 2 | Pr | 2 | 8 | 18 | 21 | 8 | 2 | Am | 2 | 8 | 18 | 32 | 25 | 8 | 2 |
| Cr | 2 | 8 | 13 | 1 | Nd | 2 | 8 | 18 | 22 | 8 | 2 | Cm | 2 | 8 | 18 | 32 | 25 | 9 | 2 |
| Mn | 2 | 8 | 13 | 2 | Pm | 2 | 8 | 18 | 23 | 8 | 2 | Bk | 2 | 8 | 18 | 32 | 27 | 8 | 2 |
| Fe | 2 | 8 | 14 | 2 | Sm | 2 | 8 | 18 | 24 | 8 | 2 | Cf | 2 | 8 | 18 | 32 | 28 | 8 | 2 |
| Co | 2 | 8 | 15 | 2 | Eu | 2 | 8 | 18 | 25 | 8 | 2 | Es | 2 | 8 | 18 | 32 | 29 | 8 | 2 |
| Ni | 2 | 8 | 16 | 2 | Gd | 2 | 8 | 18 | 25 | 9 | 2 | Fm | 2 | 8 | 18 | 32 | 30 | 8 | 2 |
| Cu | 2 | 8 | 17 | 2 | Tb | 2 | 8 | 18 | 27 | 8 | 2 | Md | 2 | 8 | 18 | 32 | 31 | 8 | 2 |
| Zn | 2 | 8 | 18 | 2 | Dy | 2 | 8 | 18 | 28 | 8 | 2 | (No) | 2 | 8 | 18 | 32 | 32 | 8 | 2 |
| Ga | 2 | 8 | 18 | 3 | Ho | 2 | 8 | 18 | 29 | 8 | 2 | Lr | 2 | 8 | 18 | 32 | 32 | 9 | 2 |
| Ge | 2 | 8 | 18 | 4 | Er | 2 | 8 | 18 | 30 | 8 | 2 | Ku | 2 | 8 | 18 | 32 | 32 | 10 | 2 |
| As | 2 | 8 | 18 | 5 | Tm | 2 | 8 | 18 | 31 | 8 | 2 | ||||||||
| Se | 2 | 8 | 18 | 6 | Yb | 2 | 8 | 18 | 32 | 8 | 2 | ||||||||
| Br | 2 | 8 | 18 | 7 | Lu | 2 | 8 | 18 | 32 | 8 | 2 | ||||||||
| Kr | 2 | 8 | 18 | 8 | Hf | 2 | 8 | 18 | 32 | 10 | 2 |
Таблица 5. Относительные электроотрицательности некоторых
химических элементов
| H | 2,1 | Sc | 1,3 | Pd | 1,35 |
| He | Ti | 1,32 | Ag | 1,42 | |
| Li | 0,97 | V | 1,45 | Cd | 1,46 |
| Be | 1,47 | Cr | 1,56 | In | 1,49 |
| B | 2,01 | Mn | 1,6 | Hf | 1,23 |
| C | 2,5 | Fe | 1,64 | Ta | 1,33 |
| N | 3,07 | Co | 1,7 | W | 1,4 |
| O | 3,5 | Ni | 1,75 | Re | 1,46 |
| F | 4,1 | Cu | 1,75 | Os | 1,52 |
| Ne | Zn | 1,66 | Ir | 1,55 | |
| Na | 0,9 | Ga | 1,82 | Pt | 1,44 |
| Mg | 1,23 | Ge | 2,02 | Au | 1,42 |
| Al | 1,47 | As | 2,2 | Hg | 1,44 |
| Si | 1,74 | Se | 2,48 | Tl | 1,44 |
| P | 2,1 | Br | 2,74 | Pb | 1,55 |
| S | 2,6 | Rb | 0,89 | Bi | 1,67 |
| С l | 3,0 | Sr | 0,99 | Po | 1,67 |
| K | 0,91 | Y | 1,11 | At | 1,9 |
| Ca | 1,04 | Zr | 1,22 | Rn | |
| Sc | 1,3 | Nb | 1,23 | Fr | 0,86 |
| Ti | 1,32 | Mo | 1,3 | Ra | 0,97 |
| V | 1,45 | Tc | 1,36 | Rh | 1,45 |
| Cr | 1,56 | Ru | 1,42 |
Таблица 6. Плотность простых веществ, г/см3
| H | Kr | 3,745 | Lu | 9,95 | |
| He | 0,178 | Rb | 1,53 | Hf | 13,1 |
| Li | 0,53 | Sr | 2,63 | Ta | 16,6 |
| Be | 1,845 | Y | 4,47 | W | 19,3 |
| B | 2,4 | Zr | 6,5 | Re | 21,04 |
| C | 2,2 | Nb | 8,57 | Os | 22,61 |
| N | 1,026 | Mo | 10,2 | Ir | 22,65 |
| O | 1,13 | Tc | 11,49 | Pt | 21,46 |
| F | 1,51 | Ru | 12,37 | Au | 19,3 |
| Ne | 0,9 | Rh | 12,41 | Hg | 13,55 |
| Na | 0,97 | Pd | 12,02 | Tl | 11,849 |
| Mg | 1,74 | Ag | 10,5 | Pb | 11,34 |
| Al | 2,699 | Cd | 8,7 | Bi | 9,79 |
| Si | 2,33 | In | 7,31 | Po | 9,32 |
| P | 1,83 | Sn | 7,29 | At | |
| S | 2,07 | Sb | 6,69 | Rn | 9,73 |
| Сl | 1,57 | Te | 6,25 | Fr | |
| Ar | 1,784 | I | 4,93 | Ra | 6 |
| K | 0,86 | Xe | 5,851 | Ac | 10,1 |
| Ca | 1,54 | Cs | 1,87 | Th | 11,7 |
| Sc | 3 | Ba | 3,76 | Pa | 15,4 |
| Ti | 4,5 | La | 6,16 | U | 19 |
| V | 6,11 | Ce | 6,77 | Np | 20,4 |
| Cr | 7,2 | Pr | 6,77 | Pu | 19,7 |
| Mn | 7,44 | Nd | 7,01 | Am | 11,9 |
| Fe | 7,87 | Pm | Cm | 13,5 | |
| Co | 8,9 | Sm | 7,54 | ||
| Ni | 8,91 | Eu | 5,24 | ||
| Cu | 8,94 | Gd | 7,89 | ||
| Zn | 7,1 | Tb | 8,25 | ||
| Ga | 5,097 | Dy | 8,56 | ||
| Ge | 5,35 | Ho | 8,78 | ||
| As | 5,72 | Er | 9,06 | ||
| Se | 4,79 | Tm | 9,32 | ||
| Br | 3,1 | Yb | 6,95 |
Таблица 7. Температуры кипения простых веществ, оС
| H | -253 | Kr | -153 | Lu | 2680 |
| He | -269 | Rb | 700 | Hf | 4620 |
| Li | 1336 | Sr | 1380 | Ta | 5500 |
| Be | 2450 | Y | 3322 | W | 5700 |
| B | 3700 | Zr | 4340 | Re | 5600 |
| C | Nb | 4927 | Os | 5000 | |
| N | -195,8 | Mo | 4600 | Ir | 4380 |
| O | -183 | Tc | 4600 | Pt | 3900 |
| F | -188 | Ru | 4200 | Au | 2947 |
| Ne | -246 | Rh | 3700 | Hg | 357 |
| Na | 880 | Pd | 2940 | Tl | 1457 |
| Mg | 1107 | Ag | 1046,5 | Pb | 1750 |
| Al | 2500 | Cd | 767 | Bi | 1560 |
| Si | 2355 | In | 2024 | Po | 962 |
| P | 281 | Sn | 2690 | At | 309 |
| S | 445 | Sb | 1637 | Rn | -62 |
| Сl | -34 | Te | 990 | Fr | |
| Ar | -186 | I | 184 | Ra | 1500 |
| K | 760 | Xe | -108 | Ac | 3590 |
| Ca | 1482 | Cs | 670 | Th | 4200 |
| Sc | 2850 | Ba | 1640 | Pa | 4300 |
| Ti | 3330 | La | 3370 | U | 3860 |
| V | 3400 | Ce | 3470 | Np | 3900 |
| Cr | 2680 | Pr | 3017 | Pu | 3235 |
| Mn | 2080 | Nd | 3210 | Am | 2600 |
| Fe | 3200 | Pm | Cm | ||
| Co | 2960 | Sm | 1670 | Bk | |
| Ni | 2900 | Eu | 1430 | Cf | |
| Cu | 2540 | Gd | 2830 | Es | |
| Zn | 906 | Tb | 2480 | Fm | |
| Ga | 2403 | Dy | 2330 | Md | |
| Ge | 2850 | Ho | 2380 | (No) | |
| As | 613 | Er | 2390 | Lr | |
| Se | 685 | Tm | 1720 | Ku | 5500 |
| Br | 60 | Yb | 1320 |
Таблица 8. Температуры плавления простых веществ, оС
| H | -259 | Kr | -157 | Lu | 1656 |
| He | -272 | Rb | 38,5 | Hf | 2230 |
| Li | 186 | Sr | 770 | Ta | 2014 |
| Be | 1284 | Y | 1528 | W | 3420 |
| B | 2075 | Zr | 1855 | Re | 3190 |
| C | 3800 | Nb | 2500 | Os | 3030 |
| N | -210 | Mo | 2620 | Ir | 2447 |
| O | -219 | Tc | 2200 | Pt | 1772 |
| F | -220 | Ru | 2250 | Au | 1046,5 |
| Ne | -249 | Rh | 1963 | Hg | -38,9 |
| Na | 97,5 | Pd | 1554 | Tl | 303,6 |
| Mg | 650 | Ag | 961,2 | Pb | 327 |
| Al | 660,4 | Cd | 321 | Bi | 271 |
| Si | 1423 | In | 156,8 | Po | 282 |
| P | 44,2 | Sn | 232 | At | 244 |
| S | 115 | Sb | 630 | Rn | -71 |
| Сl | -101 | Te | 450 | Fr | |
| Ar | -189 | I | 114 | Ra | 991 |
| K | 62,3 | Xe | -112 | Ac | 1050 |
| Ca | 851 | Cs | 28,5 | Th | 1750 |
| Sc | 1541 | Ba | 710 | Pa | 1575 |
| Ti | 1668 | La | 920 | U | 1133 |
| V | 1920 | Ce | 798 | Np | 637 |
| Cr | 1890 | Pr | 931 | Pu | 640 |
| Mn | 1245 | Nd | 1018 | Am | 1200 |
| Fe | 1539 | Pm | 1042 | Cm | 1340 |
| Co | 1492 | Sm | 1072 | Bk | |
| Ni | 1455 | Eu | 822 | Cf | |
| Cu | 1084,5 | Gd | 1311 | Es | |
| Zn | 419,5 | Tb | 1360 | Fm | |
| Ga | 29,8 | Dy | 1409 | Md | |
| Ge | 958 | Ho | 1470 | (No) | |
| As | 815 | Er | 1522 | Lr | |
| Se | 217 | Tm | 1545 | Ku | 2100 |
| Br | -7 | Yb | 824 |
Таблица 9. Относительные атомные массы химических элементов
| Водород | H | 1,0 | Криптон | Kr | 83,8 | Лютеций | Lu | 175,0 |
| Гелий | He | 4,0 | Рубидий | Rb | 85,5 | Гафний | Hf | 178,4 |
| Литий | Li | 6,9 | Стронций | Sr | 87,6 | Тантал | Ta | 181,0 |
| Бериллий | Be | 9,0 | Иттрий | Y | 88,9 | Вольфрам | W | 183,8 |
| Бор | B | 10,8 | Цирконий | Zr | 91,2 | Рений | Re | 186,2 |
| Углерод | C | 12,0 | Ниобий | Nb | 92,9 | Осмий | Os | 190,2 |
| Азот | N | 14,0 | Молибден | Mo | 95,9 | Иридий | Ir | 192,2 |
| Кислород | O | 15,99 | Технеций | Tc | [97] | Платина | Pt | 195 |
| Фтор | F | 18,99 | Рутений | Ru | 101 | Золото | Au | 197,0 |
| Неон | Ne | 20,17 | Родий | Rh | 102,9 | Ртуть | Hg | 200,5 |
| Натрий | Na | 22,98 | Палладий | Pd | 106,4 | Таллий | Tl | 204,3 |
| Магний | Mg | 24,31 | Серебро | Ag | 107,9 | Свинец | Pb | 207,2 |
| Алюминий | Al | 26,98 | Кадмий | Cd | 112,4 | Висмут | Bi | 209,0 |
| Кремний | Si | 28,08 | Индий | In | 114,8 | Полоний | Po | [209] |
| Фосфор | P | 30,97 | Олово | Sn | 118,6 | Астат | At | [210] |
| Сера | S | 32,06 | Сурьма | Sb | 121,7 | Радон | Rn | [222] |
| Хлор | Сl | 35,45 | Теллур | Te | 127,6 | Франций | Fr | [223] |
| Аргон | Ar | 39,94 | Йод | I | 126,9 | Радий | Ra | [226] |
| Калий | K | 39,09 | Криптон | Xe | 131,3 | Актиний | Ac | [227] |
| Кальций | Ca | 40,08 | Цезий | Cs | 132,9 | Торий | Th | 232,1 |
| Скандий | Sc | 44,96 | Барий | Ba | 137,3 | Протактиний | Pa | [231] |
| Титан | Ti | 47,9 | Лантан | La | 138,9 | Уран | U | 238,0 |
| Ванадий | V | 50,94 | Церий | Ce | 1140 | Нептуний | Np | [237] |
| Хром | Cr | 51,99 | Празеодим | Pr | 140,9 | Плутоний | Pu | [244] |
| Марганец | Mn | 54,94 | Неодим | Nd | 144,2 | Америций | Am | [243] |
| Железо | Fe | 55,84 | Прометий | Pm | [145] | Кюрий | Cm | [247] |
| Кобальт | Co | 58,93 | Самарий | Sm | 150,4 | Берклий | Bk | [247] |
| Никель | Ni | 58,7 | Европий | Eu | 152,0 | Калифорний | Cf | [251] |
| Медь | Cu | 63,54 | Гадолиний | Gd | 157,2 | Эйнштейний | Es | [254] |
| Цинк | Zn | 65,38 | Тербий | Tb | 158,9 | Фермий | Fm | [257] |
| Галлий | Ga | 69,72 | Диспрозий | Dy | 162,5 | Менделевий | Md | [258] |
| Германий | Ge | 72,5 | Гольмий | Ho | 164,9 | Нобелий | (No) | [259] |
| Мышьяк | As | 74,92 | Эрбий | Er | 167,2 | Лоуренсий | Lr | [260] |
| Селен | Se | 78,9 | Тулий | Tm | 168,9 | Курчатовий | Ku | [261] |
| Бром | Br | 79,90 | Иттербий | Yb | 173 |
Таблица 10. Энергия химической связи, кДж/моль
| Тип химической связи | Энергия связи, кДж/моль | Тип химической связи | Энергия связи, кДж/моль |
| H-H | 436 | N=O | 607 |
| C-H | 413 | N-F | 272 |
| N-H | 391 | NºN | 941 |
| O-H | 463 | P-H | 322 |
| F-H | 563 | P-C | 272 |
| Si-H | 323 | P-O | 415 |
| P-H | 322 | P=O | 584 |
| S-H | 339 | P-F | 490 |
| Cl-H | 432 | P-Cl | 320 |
| C-C | 348 | O-O | 139 |
| C-N | 292 | O-F | 192 |
| C=N | 615 | O=O | 494 |
| C-O | 352 | O=S | 502 |
| C-F | 441 | S-F | 327 |
| C=C | 607 | S-O | 387 |
| C=O | 724 | C-S | 259 |
| CºC | 839 | S-S | 213 |
| C-Cl | 328 | Al-F | 599 |
| Si-O | 368 | Al-Cl | 426 |
| Si-F | 541 | F-F | 155 |
| Si-Si | 226 | Cl-Cl | 243 |
| Si-Cl | 360 | Br-Br | 190 |
| N-N | 163 | I-I | 149 |
| N-O | 201 | CºN | 817 |
Таблица 11. Длина химической связи , 10-10 м
| Тип связи | Длина связи | Тип связи | Длина связи |
| H-H | 0,74 | NºN | 1,09 |
| C-H | 1,09 | P-O | 1,62 |
| N-H | 1,01 | P=O | 1,39 |
| O-H | 0,96 | P-Cl | 2,21 |
| F-H | 0,92 | O-O | 1,48 |
| S-H | 1,33 | S-S | 2,05 |
| Cl-H | 1,27 | F-F | 1,42 |
| C=O | 1,21 | Cl-Cl | 1,99 |
| N-N | 1,47 | Br-Br | 2,28 |
| N=O | 1,22 | I-I | 2,67 |
Таблица 12. Названия и формулы кислот, их солей.
| название кислоты | формула | название соли |
| Азотистая | HNO2 | нитрит |
| Азотная | HNO3 | нитрат |
| Дихромовая | H2Cr2O7 | дихромат |
| Марганцевая | HMnO4 | перманганат |
| Марганцовистая | H2MnO4 | манганат |
| Метаалюминиевая | НАlО2 | мeтаалюминат |
| Метаборная | НВО2 | метаборат |
| Кремниевая | H2SiO3 | силикат |
| Ортофосфорная (фосфорная) | Н3РО4 | фосфат |
| Муравьиная | HCOOH | формиат |
| Мышьяковая | H3AsO4 | арсенат |
| Метамышьяковая | HAsO3 | метаарсенат |
| Оловянная | Н2SnО3 | станнат |
| Ортоборная (борная) | Н3ВО3 | борат |
| Сероводородная | H2S | сульфид |
| Тетраборная | Н2В4О7 | тетраборат |
| Тиоциановая | HNCS | тиоцианат |
| Угольная | Н2СО3 | карбонат |
| Уксусная | СН3СООН | ацетат |
| Фтороводородная (плавиковая) | HF | фторид |
| Циановодородная (синильная) | НСN | цианид |
| Щавелевая | H2C2O4 | оксалат |
| Хлороводородная (соляная) | HCl | хлорид |
| Хлористая | НСlО2 | хлорит |
| Хлорная | НClО4 | перхлорат |
| Хлорноватая | НСlО3 | хлорат |
| Хлорноватистая | НClО | гипохлорит |
| Хромовая | Н2СrО4 | хромат |
| Бромоводородная | HBr | бромид |
| Иодоводородная | HI | иодид |
| Сернистая | H2SO3 | сульфит |
| Серная | H2SO4 | сульфат |
| Тиосерная | H2S2O3 | тиосульфат |
Изменение окраски кислотно-основных индикаторов в зависимости от pН раствора.
Жидкие индикаторы
| ||||||||||||||||||||
Универсальный бумажный индикатор
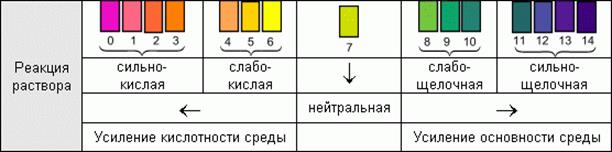
Таблица 13. Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
| Множитель, на который умножается единица | Приставки | Сокращенные обозначения | Множитель, на который умножается единица | Приставки | Сокращенные обозначения |
| 1012 | тера | Т | 10-1 | деци | д |
| 109 | гига | Г | 10-2 | санти | с |
| 106 | мега | М | 10-3 | милли | м |
| 103 | кило | к | 10-6 | микро | мк |
| 102 | гекто | г | 10-9 | нано | н |
| 101 | дека | да | 10-12 | пико | π |
Таблица 14. Пересчет водородного показателя (рН*) на концентрацию ионов водорода Н+ и обратно
| рН | [H+] | рН | [H+] | рН | [H+] | рН | [H+] | рН |
[H+] |
| 1 | 0,1 | 4 | 0,0001 | 7 | 1E-07 | 10 | 1E-10 | 13 | 1E-13 |
| 1,1 | 0,079 | 4,1 | 7,94E-05 | 7,1 | 7,94E-08 | 10,1 | 7,94E-11 | 13,1 | 7,94E-14 |
| 1,2 | 0,063 | 4,2 | 6,31E-05 | 7,2 | 6,31E-08 | 10,2 | 6,31E-11 | 13,2 | 6,31E-14 |
| 1,3 | 0,050 | 4,3 | 5,01E-05 | 7,3 | 5,01E-08 | 10,3 | 5,01E-11 | 13,3 | 5,01E-14 |
| 1,4 | 0,040 | 4,4 | 3,98E-05 | 7,4 | 3,98E-08 | 10,4 | 3,98E-11 | 13,4 | 3,98E-14 |
| 1,5 | 0,032 | 4,5 | 3,16E-05 | 7,5 | 3,16E-08 | 10,5 | 3,16E-11 | 13,5 | 3,16E-14 |
| 1,6 | 0,025 | 4,6 | 2,51E-05 | 7,6 | 2,51E-08 | 10,6 | 2,51E-11 | 13,6 | 2,51E-14 |
| 1,7 | 0,020 | 4,7 | 2E-05 | 7,7 | 2E-08 | 10,7 | 2E-11 | 13,7 | 2E-14 |
| 1,8 | 0,016 | 4,8 | 1,58E-05 | 7,8 | 1,58E-08 | 10,8 | 1,58E-11 | 13,8 | 1,58E-14 |
| 1,9 | 0,013 | 4,9 | 1,26E-05 | 7,9 | 1,26E-08 | 10,9 | 1,26E-11 | 13,9 | 1,26E-14 |
| 2 | 0,01 | 5 | 0,00001 | 8 | 1E-08 | 11 | 1E-11 | 14 | 1E-14 |
| 2,1 | 0,0079 | 5,1 | 7,94E-06 | 8,1 | 7,94E-09 | 11,1 | 7,94E-12 |
|
|
| 2,2 | 0,0063 | 5,2 | 6,31E-06 | 8,2 | 6,31E-09 | 11,2 | 6,31E-12 |
|
|
| 2,3 | 0,0050 | 5,3 | 5,01E-06 | 8,3 | 5,01E-09 | 11,3 | 5,01E-12 |
|
|
| 2,4 | 0,0040 | 5,4 | 3,98E-06 | 8,4 | 3,98E-09 | 11,4 | 3,98E-12 |
|
|
| 2,5 | 0,0032 | 5,5 | 3,16E-06 | 8,5 | 3,16E-09 | 11,5 | 3,16E-12 |
|
|
| 2,6 | 0,0025 | 5,6 | 2,51E-06 | 8,6 | 2,51E-09 | 11,6 | 2,51E-12 |
|
|
| 2,7 | 0,0020 | 5,7 | 2E-06 | 8,7 | 2E-09 | 11,7 | 2E-12 |
|
|
| 2,8 | 0,0016 | 5,8 | 1,58E-06 | 8,8 | 1,58E-09 | 11,8 | 1,58E-12 |
|
|
| 2,9 | 0,0013 | 5,9 | 1,26E-06 | 8,9 | 1,26E-09 | 11,9 | 1,26E-12 |
|
|
| 3 | 0,001 | 6 | 0,000001 | 9 | 1E-09 | 12 | 1E-12 |
|
|
| 3,1 | 0,000794 | 6,1 | 7,94E-07 | 9,1 | 7,94E-10 | 12,1 | 7,94E-13 |
|
|
| 3,2 | 0,000631 | 6,2 | 6,31E-07 | 9,2 | 6,31E-10 | 12,2 | 6,31E-13 |
|
|
| 3,3 | 0,000501 | 6,3 | 5,01E-07 | 9,3 | 5,01E-10 | 12,3 | 5,01E-13 |
|
|
| 3,4 | 0,000398 | 6,4 | 3,98E-07 | 9,4 | 3,98E-10 | 12,4 | 3,98E-13 |
|
|
| 3,5 | 0,000316 | 6,5 | 3,16E-07 | 9,5 | 3,16E-10 | 12,5 | 3,16E-13 |
|
|
| 3,6 | 0,000251 | 6,6 | 2,51E-07 | 9,6 | 2,51E-10 | 12,6 | 2,51E-13 |
|
|
| 3,7 | 0,0002 | 6,7 | 2E-07 | 9,7 | 2E-10 | 12,7 | 2E-13 |
|
|
| 3,8 | 0,000158 | 6,8 | 1,58E-07 | 9,8 | 1,58E-10 | 12,8 | 1,58E-13 |
|
|
| 3,9 | 0,000126 | 6,9 | 1,26E-07 | 9,9 | 1,26E-10 | 12,9 | 1,26E-13 |
|
|
|
|
|
|
|
|
|
|
|
|
|
*Пример: Значение рН=9,9. Концентрация [H+] = 1,26*10-10
Электрохимический ряд напряжений металлов
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb H 2 Cu Ag Hg Pt А u
Учебное издание
Составители:
Белопухов Сергей Леонидович
Шнее Татьяна Владимировна
Старых Светлана Эдуардовна
Будажапова Майя Жалсановна
Немировская Ирина Борисовна
Семко Владимир Трофимович
Федорова Татьяна Александровна
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Издается в редакции составителей
Корректура составителей








