Задание 1. Определение постоянной вискозиметра
Поскольку вязкость, плотность, а, следовательно, и время истечения являются величинами постоянными при данных условиях, то
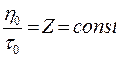
Величина Z называется постоянной вискозиметра. Тогда вязкость исследуемого золя можно рассчитать по формуле
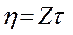
В случае разбавленных гидрофильных и гидрофобных коллоидных растворов d можно принять равным единице. В этом случае постоянную вискозиметра Z определяют по времени истечения дистиллированной воды.
Для этого в небольшой стаканчик наливают 10-15 мл дистиллированной воды. Засасывают воду в вискозиметр так, чтобы уровень воды в нем был на 2 - 3 см выше верхней метки измерительного шарика вискозиметра. Дают воде свободно вытекать, и в момент прохождения мениска через верхнюю метку измерительного шарика включают секундомер. После прохождения мениска воды через нижнюю метку измерительного шарика секундомер выключают и отсчитывают время истечения воды с точностью до 0,2 с. Повторяют определение времени истечения воды до тех пор, пока не получат трех значений, различающихся между собой не более, чем на 0,3 с. Результаты измерений записывают в таблицу 35 и рассчитывают постоянную вискозиметра с точностью до трех значащих цифр, используя среднее значение времени истечения.
Вязкость воды при 200С – 1,0050 сП, плотность – 0,99823 г/см3, вязкость воды при 250С – 0,8939 сП, плотность – 0,99707 г/см3.
Задание 2. Измерение вязкости лиофильного золя при различных значениях рН среды. Нахождение изоэлектрической точки
Приступают к измерению времени истечения растворов гидрофильного золя одинаковой концентрации, но с различными значениями рН. Измерения начинают с раствора с минимальным значением рН. Перед работой с каждым последующим раствором вискозиметр ополаскивают дистиллированной водой.
Точность измерения времени истечения каждого раствора должна быть 0,5 с.
Рассчитывают вязкость золей. Данные записывают в таблицу 41. По полученным данным строят график зависимости вязкости h лиофильного золя от рН. Допускаются и графики в координатах:
время истечения t (в cекундах) от рН;
или 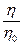 от рН.
от рН.
На графике находят ИЭТ исследуемого лиофильного золя.
Таблица 41
Результаты измерений
| Исследуемый раствор | рН раствора | Время истечения определённого объёма раствора, t, с | h раствора | |||
| Измерения | ||||||
| 1 | 2 | 3 | среднее | |||
| вода | 5,72 | |||||
| 1 % желатин | 1,54 | |||||
| 2.80 | ||||||
| 3,46 | ||||||
| 4,70 | ||||||
| 6,70 | ||||||
| 9,00 | ||||||
| 12,0 | ||||||
Z = ………
Делают выводы по проделанной работе.
СЛОВАРЬ ТЕРМИНОВ
| Абсорбция | ‒ поглощение вещества всем объемом тела |
| Агрегативная устойчивость | ‒ устойчивость частиц к взаимному слипанию (укрупнению) |
| Адгезия | ‒ возникновение связи между поверхностными слоями двух разнородных тел, приведенных в соприкосновение |
| Адсорбат | ‒ вещество, которое самопроизвольно концентрируется на разделе фаз |
| Адсорбент | ‒ вещество, на поверхности которого идет адсорбция |
| Адсорбция | ‒ самопроизвольное поглощение вещества на поверхности адсорбента |
| ‒ изотерма | ‒ графическая зависимость адсорбции от равновесного давления (газы) или равновесной концентрации (растворы) |
| ‒ локализованная | ‒ молекулы адсорбата закреплены на поверхности адсорбента |
| ‒ нелокализованная | ‒ молекулы адсорбата свободно передвигаются по поверхности адсорбента |
| ‒ обменная | ‒ эквивалентный обмен ионов одного знака (катионы или анионы) между двойным электрическим слоем адсорбента и средой |
| ‒ физическая | ‒ возникает за счет Ван-дер-ваальсовых взаимодействий, обратима |
| ‒ химическая | ‒ (хемосорбция), осуществляется только путем химического взаимодействия, необратима |
| Активность | ‒ эффективная концентрация диссоциированной части электролита в растворе с учетом межионных взаимодействий |
| Амфотерность | ‒ способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства |
| Броуновское движение | ‒ хаотическое перемещение частиц дисперсной фазы под воздействием теплового движения молекул дисперсионной среды |
| Буферная емкость | ‒ интервал, в котором проявляется буферное свойство раствора |
| Буферные растворы | ‒ растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении. |
| Водородный показатель рН | ‒ величина, характеризующая концентрацию (активность) ионов водорода в растворе, численно равна отрицательному десятичному логарифму концентрации (активности) ионов водорода, выраженной в моль на литр |
| Высокомолекулярные соединения | ‒ соединения органической природы, молекулярная масса которых от нескольких тысяч до нескольких миллионов |
| Вязкость | ‒ внутреннее трение жидкости, возникающее при истечении одного слоя относительно другого |
| ‒ относительная | ‒ отношение вязкости испытуемого золя к известной величине вязкости другой жидкости |
| Гальванический элемент | ‒ устройство, в котором энергия химических реакций, протекающих на электродах, преобразуется в электрический ток |
| Гели | ‒ дисперсные системы, характеризуются структурой, придающей им механические свойства твердых тел. Образуются при коагуляции золей, при высушивании необратимо разрушаются |
| Гидратация | ‒ взаимодействие ионов или молекул вещества с молекулами воды |
| Гидрофильность | ‒ характеристика интенсивности молекулярного взаимодействия поверхности тел с водой |
| Гидрофобность | ‒ характеристика плохой смачиваемости поверхности тел водой |
| Гранула | ‒ заряженное ядро мицеллы с роем противоионов в неподвижном слое |
| Давление | ‒ отношение силы, равномерно распределенной по нормальной к ней поверхности, к площади этой поверхности |
| ‒ насыщенного пара | ‒ характеризует равновесное состояние системы жидкость – пар при постоянной температуре |
| ‒ осмотическое | ‒ наименьшее давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя через полупроницаемую мембрану в раствор |
| Десорбция | ‒ процесс удаления адсорбированного вещества с поверхности адсорбента |
| Дзета-потенциал | ‒ разность потенциалов между подвижной (диффузной) и неподвижной (адсорбированной) частями двойного электрического слоя мицеллы |
| Диализ | ‒ процесс очистки коллоидных растворов, основанный на свойстве полупроницаемой мембраны пропускать примеси ионов и молекул малых размеров и задерживать коллоидные частицы |
| Диполь | ‒ молекула, состоящая из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры не совпадают |
| Диспергирование | ‒ тонкое измельчение твердых, жидких тел в какой-либо среде для получения коллоидных систем |
| Дисперсность | ‒ характеристика размеров частиц в дисперсных системах |
| Дисперсные системы | ‒ системы, состоящие из мелкораздробленных частиц распределенных в окружающей среде |
| Дисперсионная среда | ‒ среда, в которой находится диспергированное (раздробленное) вещество |
| Дисперсная фаза | ‒ вещество, в виде частиц различной величины, равномерно распределенное в дисперсионной среде |
| Диффузия | ‒ самопроизвольное выравнивание концентраций приведенных в соприкосновение газов, жидкостей, твердых тел |
| Диффузионный потенциал | ‒ равновесная разность потенциалов, установившаяся в пограничном слое между двумя растворами с различной концентрацией |
| Диффузия | ‒ самопроизвольный процесс распределения частиц вещества по всему обьему системы под действием теплового движения частиц |
| Закон (ы) | |
| ‒ Гесса | ‒ тепловой эффект химической реакции не зависит от пути перехода (промежуточных реакций), а зависит только от вида и состояния исходных веществ и конечных продуктов |
| ‒ Джоуля | ‒ внутренняя энергия идеального газа зависит только от температуры |
| ‒ Кольрауша | ‒ молярная электрическая проводимость при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита |
| ‒ Лавуазье – Лапласа | ‒ тепловой эффект разложения какого-либо химического соединения точно равен и противоположен по знаку тепловому эффекту его образования |
| ‒ Оствальда | ‒ степень диссоциации увеличивается с разбавлением |
| ‒ Рауля (первый) | ‒ относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе |
| ‒ Рауля (второй) | ‒ понижение температуры замерзания или повышение температуры кипения пропорционально моляльной концентрации раствора |
| Золи | ‒ коллоидные растворы, состоят из частиц дисперсной фазы равномерно распределенных в какой-либо среде, например, в воде (гидрозоли), в спирте (алкозоли), в газе (аэрозоли) и др |
| Изоэлектрическая точка | ‒ значение рН, при котором электрофоретическая подвижность белка равна нулю |
| Ингибитор | ‒ вещество, изменяющее (замедляющее) скорость химической реакции |
| Иониты | ‒ твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающей среды. Разделяются на катиониты, поглощающие катионы и аниониты, поглощающие анионы |
| Ионная сила | ‒ мера интенсивности электрического поля, создаваемого ионами в растворе |
| Ионы | ‒ частицы, представляющие собой атомы или группы химически связанных атомов, положительно (катионы) или отрицательно (анионы) заряженных |
| ‒ абсолютная скорость | ‒ отношение скорости движения иона в электрическом поле к напряженности электрического поля |
| ‒ скорость движения | ‒ скорость передвижения иона в направлении одного из электродов, выраженная в м / с |
| ‒электролитическая подвижность | ‒ произведение абсолютной скорости движения ионов на постоянную Фарадея |
| Калориметр | ‒ прибор для определения тепловых эффектов, сопровождающих химические реакции |
| Катализ | ‒ изменение скорости химической реакции, благодаря присутствию в системе некоторого вещества, состояние и масса которого в конце реакции остаются неизменными |
| ‒ гетерогенный | ‒ химическая реакция идет на границе раздела фаз, образуемых катализатором и реагирующими веществами |
| ‒ гомогенный | ‒ катализатор образует единую фазу с реагирующими веществами |
|
| |
| ‒ ферментативный | ‒ осуществляется благодаря ферментам – биологическим катализаторам белковой природы |
| Катализатор | ‒ вещество, изменяющее (ускоряющее) скорость химической реакции |
| Квантовый выход | ‒ отношение числа частиц, претерпевших химическое превращение, к числу поглощенных квантов |
| Кинетика | ‒ учение о скорости химической реакции |
| Кинетическая устойчивость | ‒ способность частиц дисперсной фазы удерживаться во взвешенном состоянии в объеме раствора |
| Коагуляция | ‒ процесс слипания коллоидных частиц с образованием более крупных агрегатов (потеря агрегативной устойчивости) с последующей потерей кинетической устойчивости |
| Коалесценция | ‒ самопроизвольное слияние капель, образующих дисперсную фазу эмульсий |
| Коацервация | ‒ коагуляция растворов ВМС, совершающаяся под действием солей и сопровождающаяся образованием гетерогенной системы |
| Когезия | ‒ работа, затраченная на преодоление сил сцепления между молекулами однородной жидкости |
| Кондуктометри-ческое титрование | ‒ метод объемного анализа, индикатором в котором служит электрическая проводимость раствора, меняющаяся в процессе химической реакции после добавления очередной порции титранта |
| Константа | |
| ‒ криоскопическая | ‒ моляльное понижение температуры замерзания |
| ‒эбуллиоскопическая | ‒ моляльное повышение температуры кипения |
| Контракция | ‒ уменьшение объема системы (полимер + растворитель) при набухании |
| Концентрация | |
| ‒ моляльная | ‒ количество Моль вещества, содержащееся в 1 кг (1000 г) растворителя |
| ‒ молярная | ‒ количество Моль вещества, содержащееся в 1 литре (1000 мл) раствора |
| ‒ процентная | ‒ количество вещества (в граммах), содержащееся в 100 граммах раствора |
| Коллоид | |
| ‒ лиофильный | ‒ растворы ВМС, образованные самопроизвольно, благодаря сильному взаимодействию дисперсной фазы и дисперсионной среды |
| ‒ лиофобный | ‒ системы, в которых частицы дисперсной фазы не взаимодействуют с дисперсионной средой |
| Коэффициент | |
| ‒ активности | ‒ мера гидратации и электростатического взаимодействия ионов в растворе |
| Краевой угол смачивания | ‒ угол, образованный каплей жидкости на твердой поверхности (измеряемый в водной фазе) |
| Криоскопия | ‒ измерение понижения температуры замерзания раствора по сравнению с чистым растворителем |
| Макромолекула | ‒ совокупность большого числа атомов, соединенных химическими связями |
| Мембрана полупроницаемая | ‒ искусственная или естественная пористая перегородка свободно пропускающая молекулы растворителя, но препятствующая проникновению молекул растворенного вещества |
| Мицелла | ‒ структурная электронейтральная единица гидрофобного коллоида, состоит из нерастворимого в данной среде ядра окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя |
| Молекулы | ‒ наименьшая частица простого или сложного вещества, обладающая его основными химическими свойствами |
| ‒ активные | ‒ обладающие избыточной энергией, необходимой для химического взаимо действия |
| ‒ дифильные | ‒ состоящие из двух частей: полярной группы и неполярного углеводородного радикала |
| Молекулярный «частокол» | ‒ вертикальное расположение дифильных молекул в поверхностном слое жидкости при высоких концентрациях вещества |
| Моляльность | ‒ количество растворенного вещества (моль) в 1 кг растворителя |
| Молярная доля | ‒ отношение количества вещества (моль) к сумме всех компонентов раствора(моль) |
| Набухание | ‒ самопроизвольный процесс поглощения ВМС больших объемов низкомолекулярной жидкости, сопровождающийся значительным увеличением объема ВМС |
| ‒ неограниченное | ‒ последовательно переходящее через все четыре стадии в полное растворение с образованием однофазной системы |
| ‒ ограниченное | ‒ не переходящее в полное растворение, а останавливающееся на второй или третьей стадии |
| Нефелометрия | ‒ метод исследования коллоидных систем, основан на сравнении интенсивности светорассеяния |
| Осмометр | ‒ прибор для определения осмотического давления |
| Параметры | ‒ величины, характеризующие какое-либо макроскопическое состояние системы |
| ‒ интенсивные | ‒ величина которых не зависит от размера системы |
| ‒ экстенсивные | ‒ величина которых зависит от размера системы |
| Парциальное давление | ‒ то давление идеального газа в смеси, как если бы он один занимал весь объем |
| Пены | ‒ высококонцентрированные грубодисперсные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ |
| Пептизатор | ‒ вещество, вызывающее расщепление агрегатов, возникших при коагуляции дисперсных систем, на первичные частицы |
| Пептизация | ‒ метод получения коллоидных растворов, основанный на применении пептизатора |
| ‒ непосредственная | ‒ пептизатор непосредственно адсорбируется на поверхности коллоидной частицы |
| ‒ посредственная | ‒ на поверхности коллоидной частицы адсорбируется продукт взаимодействия пептизатора с веществом дисперсной фазы |
| Первое начало термодинамики | ‒ в замкнутой системе сумма всех видов энергии постоянна; при их взаимопревращениях энергия не теряется и не создается вновь |
| Плазмолиз | ‒ состояние клетки, обусловленное осмотическим высасыванием воды из клетки в более концентрированный внешний раствор |
| Поверхностно - активные вещества | ‒ вещества, добавление которых к растворителю снижает его поверхностное натяжение |
| Поверхностно – инактивные вещества | ‒ вещества, добавление которых к растворителю повышает его поверхностное натяжение |
| Поверхностное натяжение | ‒ отношение величины свободной поверхностной энергии к единице поверхности |
| Полидисперсность | ‒ наличие в коллоидных системах частиц или молекул различных размеров |
| Порог коагуляции | ‒ минимальная концентрация электролита, которая вызывает коагуляцию |
| Потенциал | |
| ‒ протекания | ‒ возникновение разности потенциалов при движении жидкости относительно неподвижной твердой фазы |
| ‒ седиментации | ‒ возникновение разности потенциалов при движении частиц в неподвижной жидкости |
| ‒ электродный | ‒ ЭДС элемента, составленного из данного электрода и стандартного водородного электрода |
| Потенциалопределяющие ионы | ‒ создающие заряд на поверхности ядра мицеллы благодаря адсорбции из раствора электролита |
| Потенциометрия | ‒ метод анализа физико-химических характеристик электролитов, основан ный на измерении электродных потенциалов и ЭДС гальванических элементов |
| Правило | |
| – Панета - Фаянса | ‒ на поверхности кристаллического твердого тела из раствора адсорбируется тот из ионов, который входит в состав кристаллической решетки или может образовывать с одним из ионов решетки малорастворимое соединение |
| ‒ Траубе | ‒ в любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на СН – группу увеличивает поверхностную активность в 3-3,5 раза |
| ‒ Шульце - Гарди | ‒ коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду потенциалопределяющих ионов мицеллы, причем его когулирующая способность выражается, тем сильнее, чем выше заряд иона |
| Превращение | |
| ‒ обратимое | ‒ если система бесконечно медленно переходит из одного состояния равновесия в другое через непрерывный ряд промежуточных равновесных состояний |
| ‒ необратимое | ‒ если в результате протекания процесса в прямом или обратном направлениях в системе или в окружающей среде остаются неисчезающие изменения |
| Принцип | |
| ‒ Ле Шателье | ‒ если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении |
| Проводимость | |
| ‒ молярная | ‒ электролитическая проводимость объема раствора, содержащего 1 кмоль растворенного вещества и помещенного между электродами, находящимися на расстоянии 1 м друг от друга |
| ‒ удельная | ‒ величина, обратная удельному сопротивлению проводника |
| ‒ электрическая | ‒ металлическая проводимость, обусловленная подвижностью электронов, являющихся носителем заряда |
| ‒ электролитическая | ‒ проводимость жидкостей, вызванная направленным движением катионов и анионов к противоположно заряженному электроду при наложении на раствор внешнего электрического поля |
| Противоионы | ‒ ионы, входящие в состав двойного электрического слоя мицеллы и противоположные по знаку потенциалопределяющим ионам |
| Процесс | |
| ‒ изобарный | ‒ осуществляется при постоянном давлении |
| ‒ изотермический | ‒ осуществляется при постоянной температуре |
| ‒ изохорный | ‒ осуществляется при постоянном объеме |
| ‒ каталитический | ‒ осуществляется в присутствии катализатора |
| ‒ экзотермический | ‒ система выделяет тепловую энергию в ходе реакции в окружающую среду |
| ‒ эндотермический | ‒ система поглощает тепловую энергию в ходе реакции из окружающей среды |
| Пыль | ‒ аэрозоль с твердой дисперсной фазой, размер частиц которой составляет10-7- 10-9 м |
| Работа | ‒ разность потенциальных энергий двух состояний системы |
| Равновесие | |
| ‒ адсорбционно-десорбционное | ‒ динамическое равновесие, осуществляющееся при том условии, что скорость адсорбции равна скорости десорбции |
| ‒ динамическое | ‒ сохраняется во времени не вследствие прекращения процесса, а вследствие протекания его одновременно в двух противоположных направлениях с одинаковой скоростью |
| ‒ фазовое | ‒ характерно для гетерогенной системы, находящейся при постоянной тем пературе и давлении, в которой нет химического взаимодействия, а имеются лишь фазовые переходы вещества |
| ‒ электро- химическое | ‒ устанавливается в системе при условии, что скорость перехода ионов с электрода в раствор равна скорости перехода ионов из раствора на электрод |
| Равновесное состояние | ‒ термодинамическое состояние системы, которое не изменяется во времени, причем эта неизменяемость не обусловлена протеканием какого-либо внешнего процесса |
| Раствор | ‒ гомогенная многокомпонентная система, любая часть которой характеризуется одинаковым химическим составом и физическими свойствами |
| Растворение | ‒ самопроизвольный динамический процесс распределения молекул или ионов одного вещества среди молекул или ионов другого вещества, связанный с различными взаимодействиями химического и физического характера |
| Растворимость | ‒ достижение предельной концентрации насыщенного раствора какого-либо вещества |
| ‒ неограниченная | ‒ наблюдается при растворении полярных молекул вещества в полярном растворителе |
| ‒ ограниченная | ‒ наблюдается при растворении полярных и неполярных веществ |
| Растворитель | ‒ химические соединения или смеси, способные растворять различные вещества и присутствующие в растворе в значительно большем количестве по сравнению с другими компонентами |
| Растворов | |
| ‒ высаливание | ‒ понижение растворимости вещества в присутствии солей |
| ‒ замерзание | - наблюдается при температуре, при которой в результате охлаждения раствора происходит образование кристаллов |
| ‒ компоненты | ‒ простейшие составные части раствора, которые могут быть выделены в чистом виде и смешением которых можно получить растворы любого возможного состава |
| ‒ разбавление | ‒ величина обратная концентрации называется разведением или разбавлением раствора, и показывает объем раствора данной концентрации, в котором содержится 1кмоль растворенного вещества |
| ‒ свойства | ‒ определяются взаимодействием компонентов, которое зависит не только от вида сил, действующих между частицами, но и от формы и размеров частиц |
| Раствор (ы) | ‒ однородная смесь, состоящая из двух или большего числа веществ, состав которой в некоторых пределах может непрерывно изменяться без скачкообразных изменений свойств |
| ‒ бесконечно разбавленные | ‒ в них можно пренебречь взаимодействием между частицами растворенного вещества и взаимодействием между частицами растворенного вещества и растворителем |
| ‒высокомолекулярных соединений | ‒ термодинамически обратимые гомогенные молекулярные системы, способные сохранять агрегативную устойчивость без стабилизатора в двухкомпонентном растворе |
| ‒ гипертонические | ‒ растворы, осмотическое давление которых выше, чем внутри клеток и тканей |
| ‒ гипотонические | ‒ растворы, осмотическое давление которых ниже, чем внутри клеток и тканей |
| ‒ идеальные | ‒ смеси, в процессе образования которых отсутствуют тепловые и объемные эффекты. Свойства идеальных растворов не зависят от природы растворенного вещества, а определяются только его концентрацией |
| ‒ изотонические | ‒ растворы, осмотическое давление которых одинаково с осмотическим давлением клеток и тканей |
| ‒ кислые | ‒ если концентрация ионов – гидроксония выше 10 -6 кмоль/м |
| ‒ насыщенный | ‒ тот, в котором достигнута предельная для данной температуры концентрация растворенного вещества, при которой число молекул, поступающих в раствор и уходящих из раствора в единицу времени, становится равным |
| ‒ нейтральные | ‒ если концентрации ионов гидроксония и гидроксид-ионов равны |
| ‒ неэлектролитов | ‒ образованы веществами не способными к диссоциации, вследствие чего не проводят электрический ток |
| ‒ нулевые | ‒ концентрация электролита такова, что на поверхности электрода не возникает двойной электрический слой |
| ‒ пересыщенные | ‒ т.е. такие, в которых концентрация выше концентрации насыщенного раствора при этом система находится в неустойчивом равновесии |
| ‒ реальные | ‒ образование которых сопровождается тепловыми и объемными эффектами |
| ‒ щелочные | ‒ если концентрация ионов гидроксония ниже 10 -6 кмоль/м |
| ‒ электролитов | ‒ образованы веществами способными к диссоциации, проводят электрический ток |
| Реагенты | ‒ исходные вещества, вступающие в процесс химического превращения |
| Реакции | |
| ‒ бимолекулярные | ‒ такие, элементарный акт которых осуществляется при столкновении двух молекул (различных или одинаковых) |
| ‒ гетерогенные | ‒ протекающие на границе раздела фаз |
| ‒ гомогенные | ‒ протекающие в пределах одной фазы |
| ‒ каталитические | ‒ связаны с образованием активированного комплекса, в который помимо реагентов входят вещества, стехиометрически не являющиеся реагентами |
| ‒ константа скорости | ‒ множитель k , показывающий, с какой скоростью идет химический процесс при концентрации реагирующих веществ, равных единице |
| ‒ молекулярность | ‒ определяется по числу молекул, которые, согласно экспериментально установленному механизму, участвуют в одном элементарном химическом акте |
| ‒ мономолекуляр- ные | ‒ такие, в которых происходит химическое превращение одной молекулы |
| ‒ обратимые | ‒ такие, у которых в состоянии химического равновесия скорости прямой и обратной реакций равны |
| ‒ промежуточные | ‒ те, в которых участвуют промежуточные вещества, образующиеся в одних стадиях химического процесса и расходующиеся в других стадиях этого же процесса |
| ‒ сенсибилизиро- ванные | ‒ в которых принимает участие сенсибилизатор |
| ‒ скорость | ‒ определяется как изменение концентрации веществ в единицу времени и в единице объема |
| ‒ сложные | ‒ протекающие более, чем в одну элементарную стадию |
| ‒ сопряженные | ‒ две реакции, одна из которых, будучи самопроизвольной, вызывает протекание в этой же системе второй химической реакции, неосуществимой в отсутствие первой |
| ‒ темновые | ‒ те, в которых активация молекул осуществляется за счет передачи энергии в форме теплоты |
| ‒ тримолекулярные | ‒ в которых элементарный акт осуществляется при столкновении трех молекул |
| ‒ ферментативные | ‒ в которых принимают участие ферменты |
| ‒ фотохимические | ‒ проходящие под действием света |
| Ряд | |
| ‒ лиотропный | ‒ катионы и анионы расположенны в ряд по мере уменьшения их высаливающего действия |
| ‒ напряжений | ‒ стандартные электродные потенциалы всех электродов, измеренные относительно нормального водородного электрода, и расположенные в ряду по мере увеличения их потенциалов |
| Светорассеяние | ‒ способность дисперсных систем, степень дисперсности которых равна или больше степени дисперсности коллоидных растворов, рассевать свет |
| Седиментация | ‒ процесс оседания коллоидных частиц в растворе под действием силы тяжести |
| Сенсибилизатор | ‒ вещество, поглощающее энергию излучения и передающее ее при столкновении превращающимся молекулам |
| Синерезис | ‒ уменьшение объема студня за счет упрочения связи между молекулами ВМС с одновременным выделением молекул растворителя, образующих новую макрофазу |
| Система | ‒ часть физического мира, всякий материальный объект, обособленный физическими или воображаемыми границами раздела от окружающей среды и подвергнутый теоретическому и (или) экспериментальному изучению |
| ‒ грубодисперсная | ‒ частицы дисперсной фазы, которой имеют размеры в пределах от 10-2 до10-6 м |
| ‒ дисперсная | ‒ та, в которой одно вещество в виде частиц различной величины распределено в другом веществе |
| ‒ закрытая | ‒ если она может обмениваться с окружающей средой энергией и не может обмениваться веществом |
| ‒ изолированная | ‒ та, в которой исключен какой бы то ни было обмен веществом или энергией с окружающей средой |
| ‒ коллоидная | ‒ частицы дисперсной фазы, которой имеют размеры в пределах от 10-7 до10-9 м |
| ‒ открытая | ‒ если она может обмениваться веществом и энергией с окружающей средой |
| Скорость | |
| ‒ абсолютная | ‒ отношение скорости движения иона в электрическом поле к напряженности электрического поля |
| ‒ движения иона | ‒ скорость его передвижения в направлении одного из электродов, выраженная в м/с |
| Сольватация | ‒ процесс интенсивного взаимодействия частиц растворяемого вещества с молекулами растворителя |
|
| |
| Сорбция | ‒ самопроизвольный процесс поглощения каким-либо веществом других веществ |
| Состояние | |
| ‒ равновесное | ‒ система находится в состоянии термодинамического равновесия, если значения параметров одинаковы в любой точке системы и остаются одинаковыми во времени |
| ‒ стандартное | ‒ это физическое состояние, в котором вещество наиболее устойчиво при давлении 101,3 кПа и температуре 298 К |
| Старение золей | ‒ самопроизвольный процесс укрупнения частиц дисперсной фазы в лиофобных золях |
| Стандартная ЭДС | ‒ разность стандартных электродных потенциалов, т.е. потенциалов, возникающих на электродах при активности электродного электролита, равной единице |
| Степень | |
| ‒ дисперсности | ‒ величина обратная диаметру частиц дисперсной фазы |
| ‒ диссоциации | ‒ отношение числа распавшихся на ионы молекул к общему числу растворенных молекул |
| Студни | ‒ гомогенные системы, пространственные сетки которых образованы макромолекулами ВМС |
| Сублимация | ‒ процесс перехода вещества из твердого состояния в газообразное, минуя жидкое |
| Субстрат | ‒ вещество, на которое действует фермент |
| Суспензия | ‒ гетерогенная система, в которой твердые частицы дисперсной фазы, размером 10-7 – 10-5 м, равномерно распределены в дисперсионной среде. Неустойчивы, в них самопроизвольно протекают процессы агрегирования частиц, которые могут быть остановлены добавлением стабилизатора |
| Температура | ‒ один из важнейших термодинамических параметров, который характеризует тепловое состояние системы |
| ‒ абсолютная | ‒ соответствует 273,15 ºК, температуре таяния льда |
| ‒ замерзания | температура не выше комнатной, при которой начинается кристаллизация раствора |
| ‒ кипения | ‒ т.е. температура, при которой давление насыщенного пара жидкости становится равным нормальному атмосферному давлению: 101,3 кПа, 1 атм. |
| Теплоемкость | ‒ количество теплоты, соответствующее изменению температуры единицы количества вещества на 1ºК |
| ‒ молярная | ‒ количество теплоты, необходимое для нагревания 1 моль вещества на 1оК |
| ‒ удельная | ‒ количество теплоты, необходимое для нагревания 1 г вещества на 1оК |
| Теплота | ‒ энергетическая характеристика процесса теплообмена, измеряемая количеством энергии, которое получает или отдает в этом процессе система |
| Термометр Бекмана | ‒ точность измерения температуры 0,005 С, используется в криоскопии |
| Термопреципита-ция | ‒ процесс осаждения частиц аэрозоля на холодных поверхностях |
|
| |
| Термохимия | ‒ раздел термодинамики, изучающий тепловые эффекты, сопровождающие химические реакции |
| Термофорез | ‒ движение частиц аэрозоля в направлении снижения температуры |
| Тиксотропия | ‒ явление обратимого изотермического перехода золь – гель |
| Титрование | |
| ‒ кондуктометри-ческое | ‒ метод анализа, сущность которого заключается в измерении электрической проводимости раствора, меняющейся в процессе химической реакции пос ле добавления очередной порции титранта |
| ‒ потенциометри- ческое | ‒ метод анализа, основанный на фиксировании точки эквивалентности по резкому изменению потенциала индикаторного электрода в процессе реакции нейтрализации |
| Третье начало термодинамики | ‒ энтропия чистых веществ, существующих в виде идеальных кристаллов, при температуре абсолютного нуля равна нулю |
| Туманы | ‒ аэрозоли с жидкой дисперсной фазой |
| Тургор | ‒ состояние осмотического напряжения клетки, обусловленное повышенным осмотическим давлением |
| Удельная | |
| ‒ поверхностная энергия | ‒ величина энергии, приходящейся на единицу площади поверхности |
| ‒ электрическая проводимость | ‒ электрическая проводимость объема раствора, заключенного между электродами, имеющими площадь сечения 1 м и находящимися на расстоянии1 м друг от друга |
| Ультрамикроскопия | ‒ метод исследования коллоидных систем, основанный на использовании эффекта Тиндаля |
| Ультра-фильтрация | ‒ процесс отделения дисперсной фазы от дисперсионной среды путем фильтрования коллоидных растворов через полупроницаемые мембраны |
| Ультрацентрифу гирование | ‒ метод отделения дисперсной фазы от дисперсионной среды при использовании значительной по величине центробежной силы |
| Универсальная газовая постоянная | ‒ работа расширения 1 моль идеального газа при повышении температуры на один градус при постоянном давлении |
| Фаза | ‒ однородная часть системы, обладающая одинаковым составом, физическими и химическими свойствами и которая может быть удалена из системы чисто механическим путем |
| Ферменты | ‒ биологические катализаторы белковой природы, участвующие практически во всех биохимических процессах, обладают большой активностью и специфичностью действия |
| Физическая химия | ‒ важнейшая область химической науки, использующая все достижения физики для исследования, объяснения, установления закономерностей химических явлений |
| Флуоресценция | ‒ метод определения типа эмульсий, основанный на том, что эмульсии масла в воде под действием ультрафиолетового излучения приобретают видимую в темной камере окраску, в отличии от эмульсии воды в масле, которые обычно не флуоресцируют |
| Фотосинтез | ‒ фотохимическая реакция синтеза углеводов из диоксида углерода и воды, протекающая в растениях за счет энергии солнечного света, поглощаемого ими |
| Фотофорез | ‒ процесс перемещения частиц дисперсной фазы при их одностороннем освещении |
| Функция состояния | ‒ термодинамическая функция, значение которой зависит только от начального и конечного состояния системы и не зависит от процессов, приводящих к этим состояниям |
| Хемосорбция | ‒ химическая адсорбция, осуществляется только путем химического взаимодействия между адсорбентом и адсорбатом |
| Хлорофилл | ‒ хромофоры, поглощающие свет в видимой области спектра |
| Число переноса | ‒ отношение скорости движения данного иона к сумме скоростей движения катиона и аниона |
| Эбуллиоскопия | ‒ метод определения молекулярной массы растворенного вещества, основанный на измерении повышения температуры кипения раствора по сравнению с чистым растворителем |
| Экстракция | ‒ метод разделения веществ, кипящих в узком диапазоне температур или обладающих малой летучестью паров и высокой температурой кипения, основанный на добавлении к раствору растворителя, не смешивающегося с первым растворителем |
| Электрод | |
| ‒ водородный | ‒ в котором газообразный водород находится при давлении 101,3 кПа и насыщает платиновую пластину |
| ‒ второго рода | ‒ металл покрыт слоем малорастворимой соли этого металла и находится в растворе, насыщенном этой солью и содержащем легкорастворимую соль с тем же анионом, что и в составе малорастворимой соли |
| ‒ индикаторный | ‒ электроды первого рода, позволяют определять активность ионов металлов путем измерения их потенциалов |
| ‒ каломельный | ‒ ртутный электрод, помещенный в раствор КСl определенной концентрации и насыщенный каломелью (Hg2Cl2) |
| ‒ окислительно- восстановительный | ‒ система, состоящая из инертного металла, опущенного в раствор двух солей содержащих одноименные катионы или анионы переменной степени окисленности |
| ‒ первого рода | ‒ состоят из металлической пластинки, опущенной в раствор соли этого же металла |
| ‒ сравнения | ‒ имеет известную величину электродного потенциала |
| ‒ стеклянный | ‒ ионоселективный электрод мембранного типа, потенциал которого зависит только от активности определяемого иона по обе стороны мембраны |
| ЭДС | ‒ электродвижущая сила, которая равна равновесной разности потенциалов между двумя электродами |
| Электродиализ | ‒ метод очистки коллоидных систем, основанный на применении полупроницаемой мембраны при наложении внешнего электрического поля |
| Электролиты | ‒ соединения, которые существуют в растворе в виде ионов независимо от прохождения или непрохождения через раствор электрического тока |
| ‒ бинарные | ‒ вещества, которые в растворе распадаются на два иона |
| ‒ сильные | ‒ вещества, которые в растворе содержатся только в виде ионов |
| ‒ слабые | ‒ вещества, молекулы которых в растворе диссоциируют не полностью |
| Электроосмос | ‒ явление переноса жидкости через пористые мембраны под действием приложенной разности потенциалов |
| Электроультрафильтрация | ‒ ультрафильтрация в электрическом поле |
| Электрофорез | ‒ перенос коллоидных частиц в электрическом поле к противоположно заряженному электроду |
| Электропро- водность | ‒ способность веществ проводить электрический ток под действием внешнего электрического поля |
| ‒ электронная | ‒ если носителями тока являются электроны (проводники первого рода) |
| ‒ ионная | ‒ если носителями тока являются находящиеся в растворе ионы (проводники второго рода) |
| Электрохимия | ‒ раздел физической химии, изучающий связь между электрическими и химическими процессами |
| Элемент | |
| ‒ гальванический | ‒ устройство для получения электрического тока за счет химических реакций, протекающих на электродах |
| ‒ концентрацион- ный | ‒ устройство, состоящее из одинаковых электродов, опущенных в электролиты различной концентрации (активности), в котором работа электрического тока получается при самопроизвольном выравнивании концентрации электролитов |
| ‒ обратимый | ‒ если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же химическая реакция, но в противоположных направлениях, а так же если его ЭДС лишь на бесконечно малое значение превышает приложенную к нему извне и противоположно направленную ЭДС |
| Эмульгатор | ‒ вещество, введение которого в эмульсию приводит к снижению поверхностного натяжения раздела фаз, образованию пленки на поверхности и тем самым, к повышению устойчивости эмульсии |
| Эмульсии | ‒ система, состоящая из жидкой дисперсной фазы которая в виде капель диспергирована в жидкой дисперсионной среде |
| ‒ второго рода | ‒ дисперсная фаза – вода, дисперсионная среда – масло |
| ‒ высококонцентри- рованные | ‒ содержание дисперсной фазы в которых выше 74 %. |
| ‒ концентрирован- ные | ‒ содержание дисперсной фазы в них не более 74%, при этом сохраняется сферическая форма частиц |
| ‒ первого рода | ‒ дисперсная фаза – масло, дисперсионная среда – вода |
| ‒ разбавленные | ‒ содержание дисперсной фазы, в которых не более 0,1%. |
| Энергия | ‒ общая качественная мера движения и взаимодействия всех видов материи |
| ‒ активации | ‒ избыточная кинетическая энергия, которой должны обладать молекулы для того, чтобы они могли вступить в химическое взаимодействие |
| ‒ внутренняя | ‒ полная энергия системы, которая суммируется из кинетической и потенциальной энергий, составляющих систему атомов и молекул, а также элементарных частиц, образующих атомы и молекулы, за исключением потенциальной и кинетической энергии самой системы как целого |
| ‒ кинетическая | ‒ энергия движения |
| ‒ поверхностная | ‒ обеспечена некомпенсированными силами взаимодействия молекул на разделе фаз |
| ‒ потенциальная | ‒ энергия положения и взаимодействия частиц системы |
| ‒ свободная Гельмгольца | ‒ энергия, которая может быть затрачена на совершение полезной работы в изохорно-изотермическом процессе |
| ‒ свободная Гиббса | ‒ энергия, которая может быть затрачена на совершение полезной работы в изобарно-изотермическом процессе |
| ‒ связанная | ‒ энергия, которую невозможно превратить в полезную работу |
| ‒ связи | ‒ энергия, выделяющаяся в процессе образования ковалентной связи между двумя атомами, взятыми в газообразном состоянии |
| ‒ удельная поверхностная | ‒ энергия, приходящаяся на единицу площади поверхности |
| Энтальпия | ‒ функция состояния, характеризующая тепловой эффект процесса, протекающего при постоянном давлении |
| ‒ образования | ‒ изменение энтальпии, сопровождающее реакцию образования 1 моль этого соединения из элементов или простых веществ, при постоянном давлении |
| ‒ образования стандартная | ‒ соответствует стандартным условиям как для образования продуктов, так и для элементов: давление 101,3 кПа, температура 298 ºК, элементы находятся в наиболее устойчивом состоянии |
| Энтропийный фактор | ‒ стандартная энтропия активации |
| Энтропия | ‒ функция состояния, то количество связанной энергии, которое невозможно превратить в полезную работу |
| ‒ абсолютная | ‒ энтропия вещества, находящегося при стандартных условиях: температура298 ºК , давление 101,3 кПа |
| ‒ статистическая интерпретация | ‒ энтропия системы пропорциональна логарифму вероятности ее состояния |
| Эффект | |
| ‒ Доннана | ‒ неравномерное распределение электролитов между клеткой и внешним раствором, что обусловливает возникновение разности потенциала |
| ‒ Тиндаля | ‒ светорассеяние частицами дисперсной фазы, вызванное дифракцией световой волны |








