Задание 3. Очи стка коллоидных растворов (диализ)
Диализ основан на способности некоторых полупроницаемых мембран (животных, растительных или приготовленных искусственно) пропускать истинные растворы и не пропускать коллоидные. Диализ проводят в особых приборах - диализаторах. Для диализа небольших количеств растворов применяются пергаментные, коллодиевые мешки, свиные или рыбьи пузыри. Диализаторы состоят из двух сосудов - внутреннего и внешнего. Внутренний сосуд предназначен для диализируемой жидкости и весь или частично (дно) состоит из полупроницаемой мембраны. Внешний сосуд предназначен для растворителя и представляет собой сосуд большого размера.
Полученный гидрозоль гидрата окиси железа (Ш) выливают в подготовленный диализатор и погружают его в сосуд с дистиллированной водой. Возникшие в процессе образования гидрозоля ионы Н+ и С1- будут проникать через полупроницаемую мембрану, а ионы С1- дают специфическую реакцию с раствором AgNO3 (выпадает белый осадок). Диализ следует вести до исчезновения реакции на хлор-ионы.
Задание 4. Наблюдение броуновского движения частиц
приготовленного золя при помощи ультрамикроскопа
Под руководством преподавателя наносят на предметное стекло каплю гидрозоля, накрывают покровным стеклом, ставят в поле зрения ультрамикроскопа и наблюдают движение коллоидных частиц.
При наблюдении броуновского движения можно заметить, что чем мельче частички, тем в более интенсивном движении они находятся, поэтому они менее подвержены влиянию земного притяжения и, следовательно, больше времени находятся в равномерном распределении по всему объему дисперсионной среды.
Время сохранения равномерного распределения частиц дисперсной фазы по всему объему дисперсионной среды характеризует кинетическую устойчивость данной коллоидной системы.
Задание 5. Электрокинетические свойства коллоидных систем.
Определение знака заряда и величины ζ-потенциала гидрофобных коллоидов электрофоретическим методом
1. Приготовление золя хлорида серебра (метод реакции двойного обмена).
В колбу емкостью 100 мл наливают определенный объем (полученный по заданию преподавателя) 0,02 н раствора азотнокислого серебра. К этому раствору небольшими порциями и при непрерывном и энергичном встряхивании приливают определенное преподавателем количество 0,02н хлорида калия. В приготовленном золе хлорида серебра методом электрофореза определяют величину и знак электрокинетического потенциала.
2. Определение катода и анода источника тока.
Определяют катод и анод источника тока. Для этого на стеклянную пластинку помещают фильтровальную бумажку и смачивают её небольшим количеством насыщенного раствора КСl и каплей фенолфталеина. Вилку шнура включают в сеть. Прикасаются двумя электродами к смоченной фильтровальной бумаге, обнаруживают и помечают катод по розовой окраске фенолфталеина вокруг него (не допускать соприкосновения электродов, так как это вызовет короткое замыкание).
3. Определение ζ-потенциала методом электрофореза.
Приготовленным гидрозолем хлорида серебра заполняют электрофоретическую трубку (рис. 38): через воронку (В) наливают небольшую порцию гидрозоля. Осторожно открывают кран (К) так, чтобы гидрозоль заполнил отверстия крана, не выступая из него, следя за тем, чтобы в трубке не образовались пузырьки воздуха, после чего кран закрывают. Через одно из колен U-образной трубки наполняют её надстилающей жидкостью до половины. Затем заполняют воронку оставшимся гидрозолем, следя за тем, чтобы в трубке не образовались пузырьки воздуха. Вставляют электроды в отверстия колен U - образной трубки и измеряют расстояние l между электродами вдоль трубки по пути прохождения электрического тока (величина l написана на воронке).
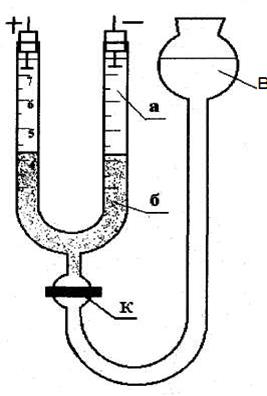
Рис. 38. Электрофоретическая трубка:
В - воронка; К - кран; а - надстилающая жидкость; б — гидрозоль.
Постепенно открывают кран. Вследствие разности уровней в трубке и воронке гидрозоль начнет медленно поступать в трубку. Чем медленнее поднимается гидрозоль, тем резче будет граница между ним и надстилающей жидкостью. При правильном заполнении электрофоретической трубки электроды должны быть погружены в надстилающую жидкость приблизительно на 0,5 см, а граница раздела - находиться в пределах градуированной части трубки.
После заполнения трубки кран закрывают и записывают положение границы золя и надстилающей жидкости в катодном и анодном коленах в таблицу 30. Включают электроды в розетку и пропускают через трубку постоянный ток в течение 5 мин. В процессе прохождения тока по вольтметру фиксируют электродвижущую силу.
Через 300 секунд выключают ток и вновь записывают положение границ раздела в таблицу 36. Вычисляют величину ζ - потенциала по уравнению
ζ = 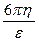 ×
× 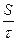 ×
× 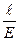
где η - вязкость дисперсионной среды, ε - диэлектрическая проницаемость, 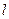 - расстояние между электродами (см), Е - электродвижущая сила (В), S - расстояние (см), пройденное дисперсной фазой за время τ (с).
- расстояние между электродами (см), Е - электродвижущая сила (В), S - расстояние (см), пройденное дисперсной фазой за время τ (с).
Таблица 36
Результаты определения ζ- потенциала
| положение границ раздела, см | смещение, S, см | время, t, сек | Е, В | l, см | ζ - потенциал | знак заряда | |||
| до прохождения тока | после прохождения тока | ||||||||
| катод | анод | катод | анод | ||||||
После подстановки постоянных величин уравнение принимает вид
ζ = 209× 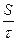 ×
× 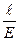
Смещение золя S равно полусумме расстояний, пройденных дисперсной фазой в катодном и анодном коленах U - образной трубки.
Знак заряда коллоидных частиц противоположен знаку заряда того электрода, по направлению к которому смещался золь.
Вопросы для самоконтроля
1. Классификация дисперсных систем по агрегатному состоянию и степени дисперсности.
2. Классификация коллоидных систем по степени взаимодействия частиц дисперсной фазы с дисперсионной средой.
3. Методы получения и очистки коллоидных систем.
4. Что такое пептизация?
5. Почему гидрофобные коллоидные системы термодинамически неустойчивые?
6. Кинетическая и агрегативная устойчивость коллоидных систем.
7. Теория двойного электрического слоя по Штэрну.
8. Строение коллоидной мицеллы.
12. КОАГУЛЯЦИЯ ЛИОФОБНЫХ И ЛИОФИЛЬНЫХ КОЛЛОИДНЫХ РАСТВОРОВ
Существуют коллоидные растворы - золи, которые образуются в результате непосредственного взаимодействия дисперсной фазы и дисперсионной среды. Такие коллоиды называются лиофильными (гидрофильными, в случае водной дисперсионной среды) или растворами высокомолекулярных соединений (ВМС). Эти коллоиды характеризуются:
1. устойчивостью в электролитах умеренной концентрации;
2. высокой вязкостью;
3. оптической однородностью при просмотре под ультрамикроскопом;
4. способностью образовывать студни без отделения дисперсной фазы от дисперсионной среды.
Лиофильными свойствами обладают гидрозоли желатины, белка, крахмала, мыла и др. Схематическое строение такой частицы дано на рисунке 39а.

| 
|
| Рис. 39а. Схема строения коллоидной частицы гидрофильного коллоида | Рис.39б. Схема строения коллоидной частицы гидрофобного коллоида |
Существует другой класс коллоидных растворов, устойчивость дисперсной фазы которых обусловлена особыми условиями образования этих коллоидов. Для того чтобы возникло взаимодействие дисперсной фазы таких коллоидов с дисперсионной средой, т.е. создались условия для сольватации, и тем самым осуществилась их устойчивость, необходимо наличие электрических зарядов у таких частиц.








