Лиофобными коллоидными системами являются такие системы, в которых частицы дисперсной фазы очень слабо взаимодействуют с молекулами растворителя.
Для получения золя гидрофобного коллоида необходимо затратить работу (химическую - получение нерастворимого вещества в ходе реакции, или физическую - растирания и др.).
Коллоидные растворы обнаруживают ярко выраженные оптические свойства. Простое наблюдение показывает, что растворы лиофильных коллоидов всегда мутные (раствор желатина, альбумина и др.), а растворы лиофобных коллоидов почти всегда имеют окраску (гидрозоль гидроокиси железа - красно-коричневую; гидрозоль берлинской лазури - синюю).
Было установлено, что при прохождении света через коллоидный раствор, коллоидные частицы рассеивают свет и тем больше, чем больше их число и сильнее интенсивность света. Этот эффект получил название конуса Тиндаля, а интенсивность свечения выражается законом Рэлея:
I = I0 k 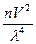
где I - интенсивность рассеянного света; Iо - интенсивность падающего света; k - константа, зависящая от разности показателей преломления дисперсной фазы и дисперсионной среды; n - число частиц в единице объема, т.е. концентрация частиц золя; V-объём частицы дисперсной фазы; λ - длина волны падающего света.
Конус Тиндаля в коллоидном растворе является выражением эффекта светорассеяния. Светорассеяние достигается только тогда, когда величина частицы, рассеивающей свет, начинает приближаться к величине длины световой волны. Истинные растворы таким свойством не обладают. По этому свойству легко отличить истинные растворы от коллоидных.
Так как молекулы некоторых веществ по своим размерам могут быть близки к размерам коллоидных частиц, то с этой точки зрения трудно провести резкую границу между истинными и коллоидными растворами. Все же между ними имеется существенное различие: в то время как истинные растворы - термодинамически устойчивые системы, устойчивость коллоидных растворов с большей или меньшей скоростью меняется во времени.
Коллоидные растворы представляют собой гетерогенные системы, что и служит одной из причин их неустойчивости. Коллоидные растворы обладают большой свободной энергией поверхности и в соответствии со вторым началом термодинамики стремятся к равновесному состоянию, характеризующемуся разделением системы на две фазы, имеющие минимальные межфазовые поверхности и, следовательно, минимальную свободную поверхностную энергию.
Устойчивость характеризуется длительностью нахождения системы в неизменном состоянии. Различают кинетическую и агрегативную устойчивость коллоидных систем.
Кинетическая устойчивость характеризуется временем сохранения равномерного распределения частиц дисперсной фазы по всему объёму дисперсионной среды.
Агрегативная устойчивость характеризуется временем сохранения неизменной степени дисперсности (раздробления частиц) дисперсной фазы коллоидной системы.
С помощью ультрамикроскопа было установлено, что коллоидные частицы находятся в интенсивном броуновском движении. Чем мельче частицы, тем интенсивнее движение, и наоборот, чем крупнее - тем меньше скорость их движения. Одновременно с этим частицы находятся под влиянием силы земного притяжения.
Таким образом, коллоидные частицы находятся под воздействием двух взаимно противоположных сил: броуновского движения, стремящегося равномерно распределить частицы по всему объему дисперсионной среды, и силы тяжести, стремящейся собрать эти частицы на дне сосуда. Чем крупнее частицы, тем сильнее проявляется действие земного тяготения, тем скорее они отделяются от дисперсионной среды и тем меньше их кинетическая устойчивость.
В природе коллоидные системы образуются двумя путями: конденсационным и дисперсионным. Воспроизведение этих путей и лежит в основе методов получения коллоидов.
В первом случае коллоиды получаются за счет соединения (конденсации) ионов или молекул с образованием более крупных частиц. Причиной вызывающей образование таких частиц является пересыщенное состояние данного вещества в среде другого вещества, в котором первое находится в растворенном состоянии. Так, например, при понижении температуры воздуха, насыщенного водяными парами, создается пересыщение, которое сопровождается образованием тумана; при сливании спиртового раствора канифоли с водой, образуется золь мастики, так как канифоль трудно растворяется в воде и вследствие этого образуются частицы канифоли коллоидных размеров.
Во втором случае - коллоиды образуются за счет раздробления (диспергирования) крупных частиц до частиц коллоидных размеров. Так, например, для раздробления глинистых минералов применяют шаровые мельницы, представляющие собой эксцентрически вращающиеся барабаны из прочной стали, частично заполненные шарами из того же материала.
Так как почвы в большинстве случаев представляют собой мелкие комочки из слипшихся между собой отдельных частиц, в том числе и коллоидных, то для разделения их на отдельные более мелкие частицы применяют химический метод раздробления. В этом случае в качестве реагента обычно употребляют растворы различных солей натрия и щелочей. Такой метод раздробления получил название пептизации.
Полученные коллоидные растворы очищают от примесей электролитной природы посредством диализа. Диализ основан на способности полупроницаемых мембран пропускать частицы истинных растворов и не пропускать коллоидные частицы, поскольку размер пор полупроницаемой мембраны меньше чем d частицы. Диализ продолжают до отсутствия качественной реакции на определяемые ионы или молекулы. Другим методом очистки коллоидных растворов является ультрафильтрация.








