2. Выбор светофильтра (см. метод абсолютной фотометрии)
3. Построение градуировочного графика. Для построения градуировочного графика измеряют относительную оптическую плотность приготовленных растворов диметилглиоксимата никеля с выбранным светофильтром по отношению к раствору сравнения. Результаты измерений вносят в таблицу.
При фотометрировании более окрашенных растворов, чем раствор сравнения (Сх > Со), применяют обычный порядок измерений и значения относительной плотности берут со знаком «плюс».
При фотометрировании менее окрашенных растворов, чем раствор сравнения (Сх < Со), применяют обратный порядок измерений: фотометрируемый раствор условно принимают за раствор сравнения и по отношению к нему измеряют оптическую плотность раствора, содержащего 4 мл стандартного раствора никеля. Значения относительной оптической плотности берут со знаком «минус». Результаты заносят в таблицу.
Строят градуировочный график (рис. 34): относительная оптическая плотность раствора (ось ординат) – объем стандартного раствора, мл (ось абсцисс).
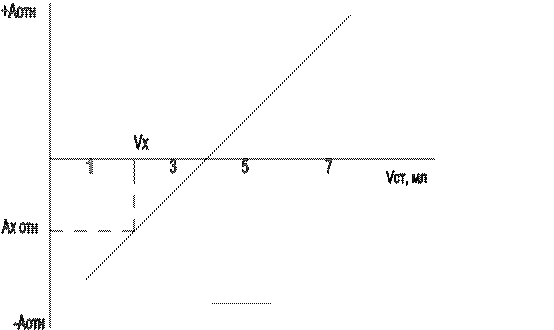
Рис. 34. Градуировочный график в методе двусторонней
дифференциальной фотометрии
4. Разложение пробы стали и приготовление анализируемого раствора. См. метод абсолютной фотометрии.
5. Определение содержания никеля в анализируемом образце стали.
Измеряют относительную оптическую плотность анализируемого раствора с тем же светофильтром и в той же кювете, которые применялись при построении градуировочного графика.
Порядок измерения оптической плотности (прямой или обратный) применяют в зависимости от концентрации анализируемого раствора (сравнить визуально окраски анализируемого раствора и раствора сравнения).
Затем по градуировочному графику находят объем стандартного раствора Vx, соответствующий измеренной относительной оптической плотности анализируемого раствора Ах отн.
Содержание никеля в стали рассчитывают по формуле:
С = Тст * Vx * а * 100/ Рстали, %, где
Тст – титр стандартного раствора никеля, г/мл;
Vx – объем стандартного раствора, мл, соответствующий на градуировочном графике относительной оптической плотности анализируемого раствора;
а – разбавление, равное 100/5=20,
Рстали – навеска стали, г, взвешенная на аналитических весах.
Содержание никеля в анализируемом растворе можно определить и расчетным путем, пользуясь формулой:
Рх = Ро + F*Ах отн., где
Рх – содержание никеля в анализируемом растворе, г; Рх = Тст * Vx, г;
Ро – содержание никеля в растворе сравнения, г; Ро = Тст * Vo, г;
Ах отн. – относительная оптическая плотность анализируемого раствора;
F – фактор пересчета, который для определяемого интервала концентраций анализируемого раствора является постоянной величиной и рассчитывается как среднее арифметическое из четырех значений F, вычисленных на основании данных табл.2 по формуле:
F = (Рст – Ро) / Аст, где
Рст – содержание никеля в стандартном растворе, г,
Рст = Тст * Vст , где (Vст = 1; 3; 5; 7)
Аст – относительная оптическая плотность, соответствующая объему стандартного раствора.
Процентное содержание никеля в стали рассчитывают по формуле:
С = Рх * а * 100 / Рстали, %
Делают выводы по работе.
Вопросы для самоконтроля
1. Можно ли рассчитать константу скорости только по значениям оптической плотности (без определения концентрации по калибровочному графику)?
2. Как, используя только результаты измерения оптической плотности раствора в ходе реакции, можно убедиться в том, что реакция гидратации уксусного ангидрида имеет первый порядок?
3. Почему константу скорости изучаемой реакции можно рассчитать по уравнению 1-го порядка? Каков полный порядок данной реакции?
4. В чем сущность метода стационарных концентраций?
5. В каких случаях используют метод стационарных концентраций?
6. Почему при расчете константы скорости реакции окисления тиомочевины принимается во внимание только концентрация гексацианоферрата (III)?
7. Почему при выполнении работ колориметрируют растворы малых концентраций?
8. Почему реакция окисления тиоацетамида имеет нулевой порядок по окислителю?
11. КОЛЛОИДНЫЕ СИСТЕМЫ, ИХ ОБРАЗОВАНИЕ И СВОЙСТВА
Область коллоидного состояния
Коллоидная химия является отраслью науки, посвященной изучению особых дисперсных систем – коллоидов. Однако понятие «коллоид» или «коллоидная система» требует уточнения, так как в разные времена и разными учеными в это понятие вкладывался неодинаковый физический смысл, а вместе с тем неодинаковые задачи и содержание приписывались и самой коллоидной химии.
В связи с этим и термин «коллоидная химия» в настоящее время является несколько устаревшим, так как она значительно меньше занимается химическим составом коллоидных систем и химическими реакциями в них, чем физической структурой, физическими (и даже механическими) свойствами и физико-химическими процессами, характерными для этих систем. Поэтому правильнее именовать ее физикохимией коллоидных систем. Поскольку, однако, в настоящее время круг изучаемых ею дисперсных систем весьма расширился, то точнее было бы именовать ее более общим термином – физической химией дисперсных систем.
Область современной коллоидной химии дисперсных систем, помимо лиофобных золей, высокомолекулярных соединений и их растворов, суспензий, эмульсий, пен, аэрозолей и твердых золей, включает еще одну практически важную группу дисперсных систем, получившую наименование «полуколлоидов».
В эту группу входят вещества, способные с одним и тем же растворителем, в зависимости от концентрации и температуры, давать и молекулярные растворы и типичные золи; к ним относятся мыла, красители и дубильные вещества.
Приведем следующее наиболее современное определение коллоидной химии, принадлежащее И.И. Жукову:
Коллоидная химия ставит своей задачей изучение физико-химических свойств:
а) всех высокодисперсных гетерогенных систем, кладя в основу поверхностные явления на границе фаз;
б) высокомолекулярных и высокополимерных соединений – как в твердом состоянии, так и в состоянии раствора.
Значение коллоидной химии исключительно велико, так как в ней изучаются не только общие вопросы познания физической сущности окружающего нас материального мира, но и вопросы, тесно и непосредственно связанные с проблемами самой жизни, поскольку все живое состоит из сложнейших комплексов веществ в коллоидном состоянии.
Трудно назвать ту отрасль промышленности, в которой в наше время коллоидная химия не находила бы своего практического применения. Такие, например, отрасли промышленности и производства, как пищевая, текстильная, искусственного волокна, кожевенная, резиновая, синтетического каучука, пластмасс, лакокрасочная, мыловаренная, взрывчатых веществ, целлюлозно-бумажная, гидролизная, фармацевтическая, обогащения руд (флотация) – самым тесным образом связаны с коллоидно-химическими процессами. Даже в таких отраслях промышленности, очень далеких, казалось бы, от коллоидной химии, как металлургическая, горнодобывающая, нефтедобывающая и нефтеперерабатывающая, силикатная и строительных материалов, все шире внедряются методы коллоидной химии.
Огромное значение имеют коллоиды и коллоидные процессы, и их изучение в сельском хозяйстве, в первую очередь для почвоведения – в вопросах повышения плодородия почв.
Велико их значение и в медицине.
В практической деятельности мы редко встречаемся с чистыми веществами, состоящими из одного компонента. Природные воды, большинство минералов, физиологические жидкости (клеточный сок растений, молоко, кровь и др.) содержат несколько компонентов.
Системы, содержащие одно или несколько веществ в виде частиц (дисперсная фаза), распределенных в той или иной среде (дисперсионная среда), называются дисперсными (от латинского dispersus ). Слово "дисперсность" означает измельчение, раздробление.
Эти системы делятся на однофазные - гомогенные и многофазные - гетерогенные. Все молекулярно-ионные растворы относятся к гомогенным однофазным системам и называются истинными растворами.
В основу классификации гетерогенных дисперсных систем положены следующие признаки:
· степень дисперсности, т.е. размер частиц дисперсной фазы;
· агрегатное состояние фаз;
· интенсивность взаимодействия частиц дисперсной фазы с
дисперсионной средой.
1. Различают три класса дисперсных гетерогенных (неод нородных) систем, отличающихся размерами частиц (d) дисперсной фазы:
· микрогетерогенные или грубодисперсные системы, d>10-7м (суспензии, эмульсии, порошки и др.);
· коллоидные или улътрамикрогетерогенные системы, 10-9 < d < 10-7м;
· истинные растворы, d < 10-9м.








