Задание 6. Изучение кинетики окисления мочевины и тиоацетамида
красной кровяной солью в щелочном растворе
Цель работы ‒ определить среднее значение константы скорости и сравнить ее с графически рассчитанной величиной, а также рассчитать энергию активации реакции и ее предэкспоненциальный множитель.
Гексацианоферрат (III) (красная кровяная соль) — сильный окислитель в щелочной среде.
Стехиометрически реакция протекает по уравнениям: для тиомочевины
NH2CSNH2 + 10(OH)- + 8[Fe(CN)6]3- = NH2CONH2 + SO42- +
+ 8[Fe(CN)6]4- + 5H2О (I)
для тиоацетамида
CH3CSNH2 + 11(ОН)- + 8[Fe (CN)6]3- = CH3COO- + SO42- + NH3 +
+ 8[Fe(CN)6]4- + 5H2O (II)
Скорости реакций (I) и (II) зависят от концентрации гидроксильных ионов в растворе, что указывает на образование промежуточного енольного аниона окисляемого вещества с гидроксильным ионом. Вещества не способные енолизироваться (как бензальдегид), не окисляются K3[Fe(CN)6]3-.
На этом основании предложен следующий механизм протекания рассматриваемых реакций:
RCSNH2 + OH- k1 RCSNH- + H2O (1)
RCSNH- + [Fe (CN)6]3- k 2 комплекс (х) (2)
комплекс ( x ) + [FeCN)6]3- k 3 2 [Fe (CN)6]4- + продукт (3)
Стадия (1) включает образование енольного промежуточного аниона субстрата и является обратимой. Скорость ее может быть больше или меньше в зависимости от природы восстановителя.
В стадии (2) промежуточный анион образует комплекс с окислителем, который в стадии (3) быстро превращается в конечный продукт реакции, или, следующий промежуточный продукт, немедленно переходящий в конечный продукт реакции. Последнее превращение происходит значительно быстрее предыдущих.
Предполагая, что концентрация активного промежуточного соединения RCSNH- стационарна, в соответствии с методом стационарных концентраций получаем
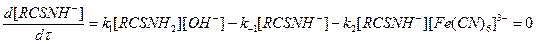
Красной кровяной солью могут также окисляться серусодержащие органические вещества (например, некоторые меркаптаны), способные образовывать промежуточные анионы, или способные енолизироваться (ацетон, пропаналь и др.).
Отсюда
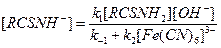
Выразим общую скорость реакции через убыль гексацианоферрата (III):
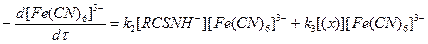
Подставляя [RCSNH-] из уравнения (4) в (5) и учитывая, что в соответствии с механизмом (1) — (3) при превращении одной молекулы RCSNH2 реагирует 2 молекулы Fe(CN)63-, получаем
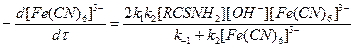
При окислении тиомочевины стадия (2) является самой медленной (лимитирующей) и определяет скорость всего процесса, поэтому k -1 > k 2 уравнение можно записать
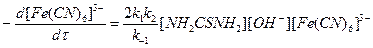
Следовательно, окисление тиомочевины щелочным раствором гекса-цианоферрата (III) имеет первый порядок по тиомочевине, гексацианоферрату (III) и гидроксильным ионам.
При окислении тиоацетамида скорость определяется стадией (1), поэтому k 1 > k 2 и k -1 < k 1 и уравнение приобретает вид
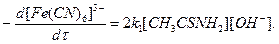
Таким образом, скорость окисления здесь не зависит от концентрации окислителя, т. е. имеет нулевой порядок по [Fe(CH)6]3- и первый порядок по тиоацетамиду и ОН- -ионам. Однако при низких концентрациях окислителя стадия (2) — лимитирующая и тогда, для расчета скорости реакции следует использовать уравнение. Лимитирующая стадия (2) включает взаимодействие двух отрицательно заряженных ионов, поэтому скорость этой реакции возрастает с увеличением ионной силы раствора (в частности, при введении КС1 в реакционную смесь), а также при увеличении диэлектрической постоянной среды. Поскольку скорости окисления тиомочевины и тиоацетамида очень чувствительны к концентрации щелочи, кинетику этих реакций изучают при постоянном значении рН и реакцию проводят в присутствии карбонат-бикарбонатной буферной смеси, которая поддерживает рН=11 (смесь равных объемов 0,1 М Na2CО3 и 0,1 M NaHCО3).
Исследование кинетики окисления тиомочевины и тиоацетамида облегчается тем, что реакция идет с заметной скоростью при температурах выше 30° и хорошо тормозится при охлаждении; ход реакции можно контролировать измерением концентрации гексацианоферрата (III) в растворе, используя фотоэлектроколориметр с синим светофильтром (с полосой пропускания 400—450 ммк); гексацианоферрат (III) не поглощает в этой области длин волн.
Последовательность выполнения работы. Один из работающих должен подготовить колориметр для измерений: включить его в сеть, выдержать время, необходимое для стабилизации прибора, и настроить его.
Одновременно другой работающий должен приготовить серию стандартных (эталонных) растворов K3[Fe(CN)6] в мерных колбах емкостью 50 мл. Готовить стандартные растворы следующих концентраций (моль/л): 1*10-4; 2*10-4; 2,5*10-4; 3*10-4; 4*10-4; 5*10-4; 6*10-4 нужно разбавлением 0,02 М раствора K3[Fe(CN)6] в карбонат-бикарбонатной буферной смеси. Результаты измерений оптической плотности стандартных растворов записать в таблицу 32:
Таблица 32
Светофильтр…… Размер кюветы ……..
| Номер колбы | Концентрация К3[Fe (CN)6], моль/л | Объем рабочего раствора для получения стандартного раствора, мл | Оптическая плотность |
После настройки колориметра приготовить и поместить в термостат с заданной температурой (выше 35°) мерную колбу емкостью 500 мл, содержащую от 10 до 40 мл 0,02 М раствора K3[Fe(CN)6] в буферной смеси; колбу, содержащую от 100 до 400 мл 0,02 М раствора тиомочевины в буферной смеси. Разбавление исходного раствора в мерных колбах производить карбонат-бикарбонатной буферной смесью.
Концентрация тиомочевины в реакционной смеси должна в 10-15 раз превышать концентрацию K3[Fe(CN)6]. Содержание тиоацетамида может быть эквивалентным содержанию гексацианоферрата (III) в растворе. При высокой концентрации восстанавливаемого вещества раствор мутнеет из-за осаждения серы. Нижний предел концентрации гексацианоферрата (III) определяется чувствительностью колориметра. При концентрации гексацианоферрата (III) в растворе, превышающей 6*10-3 моль/л, пробы для колориметрирования следует разбавлять.
Через 20-25 мин термостатированный раствор мочевины перелить в колбу с раствором K3[Fe(CN)6], отметив момент сливания растворов, как время начала реакции. Объем раствора в мерной колбе довести до метки термостатированной буферной смесью. Мерную колбу с реакционной смесью поместить в термостат. Из реакционной смеси по ходу реакции отбирать пробы, быстро охлаждать их водой со льдом и колориметрировать. Концентрацию гексацианоферрата (III) определять по оптической плотности, используя калибровочный график. Первую пробу отобрать через 5 мин после начала реакции, вторую — через 10 мин, далее — в зависимости от темпа изменения оптической плотности раствора. Объем проб определяется размерами выбранной кюветы.
Полученные результаты занести в таблицу 33:
Таблица 33
| ТоС = | Исходная концентрация K3[Fe(CN)6], моль/л | Исходная концентрация тиомочевины, моль/л | |||
| Время измерения | Время от начала реакции t, мин | оптическая плотность, Dt | Концентрация K3[Fe(CN)6], Сt | lg Co/Ct | kскор, мин-1 |
Поскольку концентрация ОН- -ионов в ходе реакции не меняется, а концентрация тиомочевины на порядок больше концентрации гексацианоферрата (III), содержание тиомочевины можно также считать постоянным и уравнение приобретает вид_
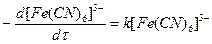
откуда видно, что константу скорости можно рассчитать по уравнению реакции первого порядка.
Энергию активации реакции рассчитать по константам скорости при двух температурах (вторую константу взять из справочника).








