Задание 5. Изучение кинетики реакции гидратации уксусного
ангидрида спектрофотометрическим методом
Цель работы ‒ определить среднюю константу скорости реакции и ее энергию активации. Скорость взаимодействия уксусного ангидрида с водой велика и титриметрические методы для кинетических исследований в этом случае непригодны. Поэтому для изучения этой реакции применяют физико-химические методы анализа. Одну из возможностей изучения кинетики этой реакции дают колориметрические исследования.
При гидратации уксусного ангидрида образуется уксусная кислота:
(СН3СО)2О + Н2О = 2СН3СООН (I)
Если в реакционную смесь ввести KI и КIO3, то по мере образования СН3СООН в ходе реакции гидратации будет протекать и другая реакция — окисление иодида иодатом:
IO3+5I- + 6Н+ → 3I2 + 3 Н2O, (II)
которая может протекать только в кислой среде. Количество выделяемого иода будет пропорционально количеству образующейся кислоты. Из уравнений (I) и (II) видно, что образование 1 моль I2 точно соответствует 1 моль прореагировавшего уксусного ангидрида. Таким образом, за скоростью реакции гидратации (I) можно следить по количеству иода, образующегося в реакции (II). Содержание иода в реакционной смеси в каждый момент от начала реакции можно определять колориметрически с использованием фотоэлектроколориметра.
Последовательность выполнения работы. Одному из работающих приготовить для измерений колориметр: включить его в сеть, выдержать время, необходимое для стабилизации прибора и настроить его в соответствии с описанием в работе. В это время второй из работающих должен приготовить серию стандартных растворов иода разбавлением 0,1 M раствора: 5*10-4; 1*10-3; 2*10-3; 7,5*10 -3; 1,2*10-2; 2,5•10-2
Для колориметрирования используется кювета толщиной 10 мм . Концентрация исходного раствора уксусного ангидрида может быть увеличена (от 0,01 м/л до 0,05 моль/л), однако тогда нужно готовить другие стандартные растворы иода и измерения проводить в кюветах меньшего размера.
Результаты измерений оптической плотности стандартных растворов следует записать в таблицу 30:
Таблица 30
Светофильтр - ….. Размер кюветы - ……… Температура - ……
| Номер колбы | Концентрация I2, моль/л | Количество раствора I2 для разбавления | Оптическая плотность |
Полученные данные использовать для построения калибровочного графика, откладывая по оси абсцисс концентрацию растворов I2, а по оси ординат — оптическую плотность.
Приготовить раствор уксусного ангидрида для кинетических исследований. Для этого приготовить 100 мл раствора, содержащего 0 2 М КIO3 и 1,0 М KI (или использовать уже имеющийся раствор). Взвесить на аналитических весах 0,06 мл уксусного ангидрида (его объем можно изменять в пределах от 0,2 до 0,01 мл) и перенести навеску в 50-мл мерную колбу, содержащую 30—40 мл раствора 0,1 М КI + 0,2 М КIO3 и довести объем этим же раствором до метки. Отметить по секундомеру время сливания уксусного ангидрида с раствором KI + КIO3 и время конца его растворения (момент гомогенизации раствора), не выключая секундомера до завершения реакции. Время, среднее между началом и концом растворения уксусного ангидрида, принять за начало реакции. Полученной реакционной смесью заполнить одну из кювет фотоэлектроколориметра, в качестве раствора сравнения использовать применяемый иодид-иодатный раствор. По мере протекания реакции измерять оптическую плотность раствора. При этом один из работающих измеряет оптическую плотность раствора, а другой записывает показания секундомера и колориметра. Два-три измерения произвести через 30 сек, четыре-пять измерений — через 1 мин, два-три измерения - через 5 мин, по одному измерению - через 10 мин, 20 мин, 30 мин и 1 ч. Неизменность оптической плотности раствора в последних измерениях свидетельствует об окончании реакции (Dконеч).
При обработке экспериментальных данных следует учитывать, что реакция гидратации уксусного ангидрида псевдомономолекулярна, и рассчитывать константу скорости по уравнению
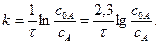
Растворы иода готовить растворением его в 1 М KI.
Концентрацию уксусного ангидрида в исходном растворе (С0) рассчитать по его навеске, а убыль концентрации к моменту измерения (Сх) - по оптической плотности раствора при помощи калибровочного графика.
Результаты наблюдений и расчетов свести в таблицу 31:
Таблица 31
Температура опыта….. Навеска уксусного ангидрида…..
| Время измерения | Время от начала реакции | Dt | Cx | Co - Cx | lg (Co – Cx) | k (с указанием размерности) |
Вычислив k реакции для каждого момента от начала реакции, определить ее среднее значение и сравнить с kср, полученной по графикам lg (Со - C х ) ‒ f (t) или lg (Dконеч – Dt) – f (t), как тангенс угла наклона прямой к оси t.
По константам скорости при двух температурах (вторую константу взять из справочника) рассчитать энергию активации данной реакции.








