Задание 4. Изучение кинетики кислотного гидролиза комплексных ионов Со3+ спектрофотометрическим методом
При изучении кинетики химических реакций широко используются физико-химические методы анализа, которые позволяют определять состав реакционной смеси по ее свойствам. Большое значение имеет при этом колориметрический метод. В отличие от химических методов он требует меньше времени, при этом обычно вещество анализируется непосредственно в растворе (без выделения) и в очень малом количестве.
Колориметрические определения основаны на сравнении поглощения или пропускания света стандартным и исследуемым окрашенными растворами. В практике преобладают фотоколориметрия, где для измерений используются фотоэлементы, так как визуальные измерения менее объективны.
В основе метода лежит объединенный закон Бугера — Ламберта — Бэра который можно выразить уравнением
D = εСl ,
где D — оптическая плотность:
D = lg Io / I
I0 — интенсивность падающего светового потока; I — интенсивность светового потока после прохождения через раствор; C — концентрация растворенного вещества, моль/л; l — толщина поглощающего слоя, см; ε — молярный коэффициент погашения.
Молярный коэффициент погашения представляет собой оптическую плотность 1 М раствора, помещенного в кювету с толщиной слоя 1 см . Он зависит от длины волны падающего света, температуры раствора и природы растворенного вещества и растворителя, но сохраняется постоянным при изменении толщины поглощающего слоя, концентрации растворенного вещества и интенсивности падающего света.
Соотношение I / I 0 характеризует прозрачность раствора и называется пропусканием (Т). Величина пропускания Т может изменяться от 0 до 1. Иногда эту величину выражают в процентах:
T = I / Io * 100%
Если величина Т отнесена к толщине слоя в 1 см , то она называется коэффициентом пропускания.
Оптическая плотность может принимать значения от 0 до оо, однако современные приборы позволяют измерять ее значения в пределах 0 до 2.
Закон Бугера — Ламберта — Бэра справедлив только для монохроматического излучения в средах с постоянным показателем преломления. При изменении концентрации вещества в растворе также могут проявляться отклонения от закона Бэра, в связи с возможностью полимеризации, гидролиза, диссоциации, ассоциации, комплексообразования и т. п. С ростом концентрации вероятность всякого такого рода изменений в растворе возрастает, поэтому отклонения от закона Бэра увеличиваются. Этот закон описывает поведение разбавленных растворов.
При разбавлении концентрированных окрашенных растворов электролитов изменяется степень диссоциации, что также вызывает отклонения от закона Бэра. В таких случаях следует разбавлять раствор не чистым растворителем, а раствором индиферентного (в отношении оптической плотности) вещества, компенсирующего убыль концентрации основного реагента при разбавлении. Изменения оптической плотности могут быть связаны также с изменением кислотности среды, поэтому часто измерения проводятся в буферных растворах. Если раствор пропускает свет в соответствии с законом Бэра, то на графике зависимости оптической плотности от концентрации получается прямая линия, идущая от начала координат. Отклонения от прямолинейности не означают, что система непригодна для колориметрического анализа. Полученная по экспериментальным данным зависимость D - f (с) в виде кривой может далее служить калибровочным графиком. При помощи этой кривой по оптической плотности раствора может быть определена концентрация данного компонента в растворе.
Недостаточная монохроматичность поглощаемого светового потока обычно вызывает отрицательные отклонения от закона Бэра. Чем шире интервал длин волн поглощаемого света, тем меньше область концентраций, где соблюдается этот основной закон светопоглощения. Для увеличения чувствительности и точности фотометрического определения нужно выделять из всей видимой области спектра определенные длины волн. Для этого на пути светового потока перед поглощающим раствором помещают избирательный светофильтр.
Светофильтры (стекла, пленки, растворы) пропускают лучи только в определенном интервале длин волн с полушириной пропускания. Светофильтры выбирают, исходя из спектра поглощения определяемого вещества так, чтобы спектральная область максимального поглощения лучей окрашенным раствором совпадала с областью максимального пропускания лучей светофильтром, т.е. чтобы максимум поглощения раствора соответствовал максимуму пропускания (минимуму поглощения) светофильтра. Если спектральные характеристики для окрашенного раствора и светофильтра отсутствуют, нужный светофильтр подбирают экспериментально. Для этого готовят две пробы исследуемого раствора различной концентрации и измеряют их оптические плотности со всеми имеющимися светофильтрами. Затем для каждого светофильтра находят разность оптических плотностей, соответствующую взятой разности концентраций окрашенного раствора. Светофильтр, дающий наибольшую разность оптических плотностей, является наиболее подходящим для колориметрирования данного окрашенного раствора. Поскольку степень поглощения светового потока раствором обычно для одних длин волн больше, чем для других, выходящий пучок света бывает окрашен.
При спектрофотометрических измерениях необходимо построить график зависимости оптической плотности от концентрации раствора (калибровочный график) после выполнения серии измерении стандартных растворов. Затем измерить оптическую плотность исследуемого раствора неизвестной концентрации и определить по калибровочному графику концентрацию исследуемого раствора.
В данной работе изучается кинетика кислотного гидролиза комплексных ионов Со3+ спектрофотометрическим методом.
Исследуется кислотный гидролиз дихлордиэтилендиаминокобальт (III) хлорида транс - [Со (en)8 Cl2]+C1, однако допустимы варианты и с другими диаминовыми комплексами. Следует определить среднюю константу скорости (аналитическим и графическим способами) время полупревращения и энергию активации реакции.
Простые реакции замещения в октаэдрических комплексных соединениях (координационное число 6), которые для комплексов Со можно представить в виде:
Co3+L6X + Y = [CoL5Y] + X
(где X и Y — обменивающиеся лиганды; L — монодентатные лиганды), в действительности являются двухстадийными процессами в водном растворе. Обычно первая стадия - процесс замещения X на молекулу Н2О, а вторая - последующее замещение Н2О на Y. Существует лишь небольшое число реакций, в которых X, замещается сначала другими лигандами, которые обычно вступают в комплекс, замещая воду, а не молекулами Н2О. Поэтому специфическая реакция акватации (или гидролиза), когда Y представляет собой воду (или ОН при щелочном гидролизе), как промежуточная стадия при обмене лигандами, имеет особое значение. Скорость гидролиза аминных комплексов Со3+ зависит от рН и описывается уравнением
V = kA[CoL6X]2+ + kB[CoL5X]+[OH-]
где kA и kB — константы скорости кислотного и основного гидролиза соответственно. При гидролизе в кислой среде второе слагаемое становится пренебрежимо малым, и выражение для скорости приобретает вид
V = kA[CoL6X]2+
Реакции типа:
[Со (NH3)6Cl]2+ + H2O → [Co(NH3)5 H2O]3+ + C1-
относятся к псевдомономолекулярным, поскольку они протекают в разбавленных растворах, в которых концентрация воды значительно превышает концентрацию комплекса и может считаться постоянной. Такого типа реакции имеют первый порядок по комплексу и нулевой по воде.
Реакция акватации комплексов состава транс ‒ [Со(АА)2С12]+ протекает по стадиям:
[Со(АА)2С12]+ + Н2O = [Со(АА)2Н2ОС1]2+ + Сl- ... (I)
[Со (АА)2 Н2ОС1]2+ + Н2O = [Со (АА)2 (Н2O)2]3+ + Сl- ... (II)
-H+ ↕ H+ -H+ ↕ H+
[Со (АА)2ОНС1]+ + Н2O = [Со (АА)2 (Н2O) ОН]2+ + Сl- ... (III)
где АА — бидентатный лиганд — лиганд с координационной емкостью, равной двум. Таким лигандом может быть:
этилендиамин NH2—СН2—СН2—NH2;
1,2‒пропилендиамин СН3—СН(NH2)—СН2—NH2;
три-метилендиамин H2N(СН2)3—NH2;
1,2-изобутилендиамин NH2—СН2— С (СН3)2—NH2 и т. п.
Реакции (I) — (III) проходят с разной скоростью. Скорость замещения второго атома хлора в аква-комплексе [стадия (II)] очень мала. Однако при протекании стадии (III) в щелочной среде образуется гидроксокомплекс, который гидратируется гораздо быстрее. Чтобы выяснить кинетику стадии (I), необходимо затормозить стадию (III), используя сильнокислую среду (рН < 3). Для исследований удобен спектрофотометрический способ. В области длин волн от 520 до 560 ммк исходный комплекс транс‒ [Со (еn)2 С12]+ имеет минимум на кривой поглощения, в то время, как конечный продукт аквокомплекс — транс‒ [Со (еn)2 Н2ОС1]2+ — максимум. Следовательно, за скоростью реакции можно следить по концентрации продукта реакции, измеряя оптическую плотность раствора.
Последовательность выполнения работы. Подготовить спектрофотометр: включить, подобрать светофильтр (зеленый с максимумом пропускания в интервале 520—560 ммк) и настроить прибор. Второму работающему приготовить в 100-мл мерной колбе 0,005 М раствор комплексной соли [Co(en)2 Cl2] C1 (или другой), подвергающейся гидролизу, в 0,1 М растворе HNO3. Для этого соответствующую навеску соли, взятую на аналитических весах, растворить в 0,1 М растворе HNO3. Если исследования проводятся не при комнатной температуре, раствор HNO3 предварительно термостатировать. Отметить по секундомеру время начала и конца растворения соли. Среднее время принять за начало реакции. Проверить при помощи индикаторной бумаги рН раствора (рН должно быть < 3).
Половину приготовленного раствора поместить на 3,5‒4 часа в термостат при 38—40° для скорейшего завершения реакции (если опыт ведется при 40° и выше, этого делать не следует). Оставшуюся часть раствора использовать для измерений его оптической плотности во времени Dt . Для исследований использовать кювету с толщиной слоя 10 мм (размер кюветы может быть и другим при иной концентрации исходного раствора). Первые два-три измерения произвести через 3-5 мин, два-три измерения — через 10 мин, затем — через 30 мин, 1 ч и т. д., постепенно увеличивая время между измерениями. Всего выполнить 10-12 измерений. Для определения периода полупревращения исходного вещества в продукт реакции установить визуальное наблюдение за изменением окраски раствора, выдерживая часть его при температуре опыта. Исходный раствор имеет зеленую окраску, а продукт реакции окрашен в красный цвет, в момент полупревращения раствор становится буровато-серым.
После всех измерений определить оптическую плотность раствора, термостатированного при 40°, охладив часть его до температуры опыта. Неизменность оптической плотности этого раствора при повторном измерении через 30—40 мин указывает на окончание реакции. Полученное значение оптической плотности соответствует D конеч .
Результаты наблюдений и расчетов занести в рабочую тетрадь:
Температура опыта......
Концентрация комплексной соли в растворе, моль/л
Концентрация HNO3 в растворе, моль/л
рН раствора.......................................
Время начала растворения
Время конца растворения
Время от начала реакции, мин
Изучаемая реакция имеет первый порядок, поэтому константу скорости рассчитывать по уравнению
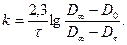
По экспериментальным данным построить графики в координатах: ( D конеч - Dx ) - f (t); lg (Dконеч — Dx ) = f (t). Поскольку D0 в момент начала реакции измерить не удается, эту величину определить по графику lg ( D конеч - Dx )= f (t) экстраполяцией до t = 0. Определить среднюю константу скорости по этому же графику по тангенсу угла наклона прямой к оси t и сравнить ее со средней константой скорости, рассчитанной по уравнению.
Рассчитать период полупревращения и сравнить с экспериментально определенной величиной.
Вопросы для самоконтроля
1. Какие законы лежат в основе колориметрического метода анализа?
2. Что такое оптическая плотность раствора и от чего она зависит?
3. Каково устройство фотоэлектроколориметра и в чем состоит принцип его действия?
4. Как подобрать светофильтр для колориметрирования?
5. Почему применяется колориметрический метод для изучения реакции аква-тации транс — [Со(еn)2С12]С1?
6. Какое значение имеет рН раствора при изучении кинетики гидролиза диа-миновых комплексов Со3+?
7. Почему особое значение приписывается первой стадии акватации рассматриваемых комплексов?
8. Как можно по графику ( D конеч — Dx ) = f (х) проверить порядок реакции и рассчитать константу ее скорости?








