Задание 2. Изучение скорости гидратации уксусного ангидрида
В данной работе следует использовать один из электрохимических методов анализа, например, определение электропроводности, для изучения кинетики реакции, определить аналитически и графически среднюю константу скорости, энергию активации и предэкспоненциальный множитель реакции гидратации уксусного ангидрида:
(СН3СО)2О + Н2O = 2СН3СООН
Эта реакция бимолекулярна в ацетоне или уксусной кислоте. Однако в разбавленном водном растворе она протекает как реакция первого порядка и практически до конца (принадлежит к классу псевдомоно-молекулярных реакций). Кинетику этой реакции следует изучать методами физико-химического анализа. К наиболее удобным методам относится метод измерения электропроводности в течение реакции, который позволяет непрерывно наблюдать за ходом реакции без отбора проб. Электропроводность системы со временем значительно возрастает вследствие образования уксусной кислоты.
Примечание. Вязкости растворов уксусного ангидрида и уксусной кислоты близки, поэтому изменение вязкости раствора в ходе реакции очень мало и практически не влияет на электропроводность.
Концентрация образующейся уксусной кислоты определяется по электропроводности раствора.
Последовательность выполнения работы. После установки термостата на указанную температуру и проверки постоянства температурного режима (допустимые колебания температуры 0,1 - 0,2°С) следует собрать схему для измерения электропроводности и включить прибор в сеть. В мерную колбу емкостью 50 мл поместить 6 мл уксусного ангидрида и довести объем раствора дистиллированной (предварительно термостатированной) водой до метки. В момент начала растворения уксусного ангидрида включить секундомер и не выключать его до конца опыта (до установления постоянного значения электропроводности). Отметить по секундомеру время начала и конца растворения, (при приливании воды четко видна граница раздела двух жидких слоев после взбалтывания наблюдается помутнение. Момент исчезновения мути принять за конец растворения). Среднее время принять за время начала реакции. Растворение проводить при энергичном перемешивании. Сосуд для измерения электропроводности, снабженный притертой крышкой, после двукратного промывания (ополаскивания) исследуемым раствором заполнить этим же раствором. Электроды должны быть погружены в раствор на 0,5—1 см ниже уровня раствора. Сосуд погрузить в термостат, в котором встряхивать его в течение 3 мин до установления постоянного температурного режима.
Один из работающих измеряет электропроводность, другой следит за секундомером и записывает показания секундомера и реохорда.
Измерение электропроводности проводится тем чаще, чем выше температура опыта. Два-три измерения произвести через 30 сек, четыре-пять измерений — через 1 мин, два-три измерения — через 5 мин одно после другого, далее сделать измерения через 10 мин, через 1 ч и еще через 1 ч. Постоянство показаний указывает на конец реакции. Результаты измерений записать в таблицу 29.
Таблица 29
Температура опыта ……… Концентрация раствора…….
| № измерения | Время измерения | Время от начала реакции, мин. | Электропроводность ратвора | k с указанием ее размерности |
При обработке результатов измерений следует учитывать, что исследуемая реакция является реакцией первого порядка.
Увеличение электропроводности во времени пропорционально концентрации образовавшейся уксусной кислоты. Количество образовавшейся уксусной кислоты пропорционально количеству взятого уксусного ангидрида, поэтому увеличение электропроводности в течение реакции будет пропорционально начальной концентрации уксусного ангидрида. Если обозначить электропроводность раствора в момент начала реакции ĸ0, электропроводность в данный момент ĸ х , электропроводность, соответствующую последнему измерению ĸ кончеч, когда она уже не меняется, тогда
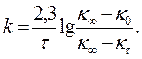
Вычислив константу скорости реакции для каждого момента, определяют среднее ее значение и сравнивают с kср, полученной графически (тангенс угла наклона прямой к оси t). По константам скорости при двух температурах (вторую константу взять из справочника) рассчитать энергию активации данной реакции.








