Особенности кинетики реакций в растворах
Скорость многих реакций почти не меняется при проведении их в растворе или в газовой фазе. Однако существует множество реакций, которые вообще не идут без растворителя. Присутствие растворителя сильно влияет на скорость реакции, если она сопровождается существенным перераспределением зарядов между реагирующими частицами, т.е. в гетеролитических реакциях. Здесь образование активного комплекса сопровождается значительной перестройкой сольватных оболочек.
Скорость реакции в водном растворе при 25° имеет вид
ln k = ln k0 + l,02 zAzB√ I
где I – ионная сила раствора, zA и zB – заряды ионов. Константа скорости в разбавленных растворах солей возрастает с увеличением ионной силы раствора, если взаимодействуют ионы одного знака, и тем больше, чем больше их заряд. Для ионов разного знака в тех же условиях константа скорости убывает. Если одно из реагирующих веществ является нейтральной молекулой, то произведение zAzB обращается в нуль, и скорость реакции в разбавленном растворе не зависит от ионной силы среды.
Изменение скорости реакции с вариацией ионной силы раствора называется первичным солевым эффектом. При этом скорость реакции изменяется в соответствии с коэффициентами активности ионов, участвующих в реакции. Присутствие солей, кроме того, может влиять на концентрацию реагирующих ионов слабого электролита (воздействуя на его диссоциацию или гидролиз). Вызванное этим изменение скорости реакции называется вторичным солевым эффектом.
Скорость реакции в растворе может существенно зависеть от диэлектрической постоянной растворителя. Степень электростатического взаимодействия ионов, полярных молекул и ионов с полярными молекулами определяется диэлектрической постоянной среды, поэтому и константа скорости реакции между этими частицами зависит от диэлектрической постоянной. Эта зависимость выражается уравнением Скетчарда
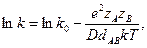
где zAe и zBe — заряды ионов; D — диэлектрическая постоянная; k - константа Больцмана; Т — температура; k0 — константа скорости в среде с бесконечно большой диэлектрической проницаемостью; dAB - характеризует размер активного комплекса, который определяется принятой моделью его строения.
Константа скорости реакции между одноименно заряженными ионами растет с увеличением D, а при взаимодействии разноименных уменьшается.
Строение активного комплекса, его свойства определяют величину предэкспоиенциального множителя в уравнении Аррениуса, изменяя энтропию активации
ΔS≠ = S≠ — ∑ S исх. част
а, следовательно, и значение стерического фактора Р. Активный комплекс, образованный ионами одного знака, несет двойной заряд, поэтому электростатическое его воздействие на соседние молекулы paстворителя возрастает по сравнению с исходными ионами (эффект электронаправленности). В результате хаотичность в расположении молекул растворителя уменьшается и энтропия активации становится отрицательной (ΔS≠ <0), т. е. стерический фактор Р < 1.
Активный комплекс из ионов противоположного знака несет меньший заряд, чем у реагентов, поэтому создает вокруг себя менее мощное электрическое поле и хаотичность в расположении молекул растворителя увеличивается по сравнению с исходным состоянием. Поэтому энтропия активации здесь положительна (ΔS≠ > 0) и стерический фактор Р > 1.
корость реакции может изменяться также за счет сольватации исходных веществ или активированного комплекса. При сольватации исходных веществ энергия активации реакции возрастает (т. е. скорость убывает), при сольватации активированного комплекса энергия активации убывает, т. е. скорость реакции возрастает. Различие в реальной системе энергетических эффектов сольватации исходных веществ и активированного комплекса затрудняет расчет скорости реакции
Реакции в растворах классифицируются по скоростям их протекания:
1) мгновенные — это реакции электростатического взаимодействия между ионами противоположного знака;
2) быстрые, у которых вычисленная по теории соударений скорость, меньше экспериментальной (стерический фактор Р > 1 или может достигать 108); это могут быть ионные реакции с изменением ковалентных связей ионов (комплексных и органических) и молекулярные реакции;
3) нормальные, экспериментальная константа скорости которых
совпадает с теоретической. Здесь Р=1. Чаще всего это - взаимодействие молекул с ионами или взаимодействие полярных молекул;
4) медленные (реакции Меншуткина, типа RHal + R3N = R4NHal), экспериментальная константа скорости этих реакций меньше теоретической (Р < 1 и может достигать 10-10). Малая величина стерического фактора здесь объясняется предположением о полярности активного комплекса, сходного по строению с конечными продуктами реакции, большей ориентацией вокруг него молекул растворители и, следовательно, отрицательным значением ΔS≠. Скорость этих реакций в сильной степени зависит от природы растворителя.








