Зависимость скорости необратимых реакций от концентрации реагирующих веществ
Реакции первого порядка. К этим реакциям относятся реакции изомеризации, термического разложения веществ, реакции радиоактивного распада и многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной.
Для реакций типа А → С скорость выражается уравнением
V = ‒ dC/dt = k*CA
dC/dt = ‒ k*CA
Интегрируя последнее уравнение, получаем
ln CA = ‒ kt + const
Значение const определяем из начальных условий. Для t = 0 CA = СOA, при этом ln CA = const:
ln CА ‒ ln CоA = ‒ kt
ln (COA/CA) = kt
Окончательно получаем
k = 1/t* ln(COA/CA) = 2,3/t*lg(COA/CA)
где COA — начальная концентрация реагирующего исходного вещества; CA - концентрация его к моменту времени t от начала реакции. Так как CA = COA – СХ, где СХ — концентрация прореагировавшего вещества за истекший промежуток времени (от начала реакции до момента определения концентрации), то
k = 2,3/ t*lg[COA/(CO-CX)]
В экспоненциальной форме
CA = CO*e-kt
Это уравнение показывает, что CA достигает COА/e в момент времени t = 1/k, где t — среднее время жизни, которое необходимо для того, чтобы концентрация исходного вещества уменьшилась в е раз; е - основание натурального логарифма. Отсюда следует, что константа скорости для реакции первого порядка выражается в размерности обратной времени.
В реакции первого порядка за единицу времени превращению подвергается одна и та же часть вещества независимо от исходной концентрации. Например, если в первые 10 мин в реакцию вступило 5% всего взятого вещества, то за последующие 10 мин прореагирует 5% от оставшихся 95% вещества.
Реакции второго порядка. К ним принадлежит большинство бимолекулярных реакций и некоторые тримолекулярные реакции. Примером реакции второго порядка может служить реакция омыления сложного эфира щелочью.
Реакцию второго порядка можно представить схемой
A + В → продукты реакции
Если исходные вещества взяты в равных концентрациях, т.е СА = СВ то скорость реакции будет
‒ dC/dt = k*C2
или после интегрирования
1/C = kt + const
или, взяв определенный интеграл, получаем
k = 1/t (1/C – 1/CO)
Заменив C на CO - CX, получим
k = 1/t* [CX/ CO/(CO-CX)]
При CA ≠ CB уравнение скорости реакции в дифференциальной форме имеет вид
‒ dC/dt = k*CA*CB = k*(COA – CX)*(COB – CX)
Проинтегрировав последнее уравнение, получаем
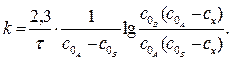
Разновидностью реакций второго порядка являются автокаталитические реакции, в которых катализатором служит один из продуктов реакции. В этих реакциях концентрация катализатора увеличивается со временем. Для них дифференциальное уравнение скорости приобретает вид
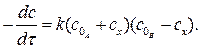
После интегрирования
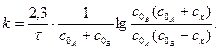
Пример такой реакции — реакция иодирования ацетона. Из уравнений следует, что при этом размерность k определяется величиной, обратной концентрации и времени (t-1*C-1).
Реакции третьего порядка. Эти реакции очень редки. В газовой фазе известно всего пять таких реакций: это взаимодействие NO с Н2, O2, Сl2, Вг2, I2. Например,
2NO + O2 → NO2
2NO + Cl2 → 2NOCl
В таких реакциях истинный механизм состоит в том, что реагирует димер (NO)2, и относительно концентрации димера эта реакция представляет собой реакцию второго порядка:
(NО)2 + Cl2 → 2NOC1
а в отношении мономера — реакцию третьего порядка. Реакциями третьего порядка являются также процессы рекомбинации атомов или свободных радикалов в молекулы. Например Н* + Н* + М → Н2 + М*, где М — третья частица, которой отдается избыточная энергия. Такие реакции относятся к элементарным и для них значения молекулярности и кинетического порядка совпадают.
В растворах известно большее количество реакций этого типа. Это, главным образом, реакции окисления — восстановления и реакции рекомбинации. При СОА = СОВ = СОD для реакции А + В + D получаем дифференциальное уравнение скорости:
- dC/dt = kc3
и после интегрирования
1/2C2 = kt + const
Размерность k определяется величиной, обратной времени и квадрату концентрации.
Реакции дробных порядков. Дробный порядок реакций указывает обычно на одновременное протекание нескольких этапов реакций, мало отличающихся друг от друга по скоростям, или на протекание обратимых реакций. Кроме того, дробный порядок реакций может быть при участии в реакциях атомов наряду с молекулами. Например, реакция превращения ортоводорода в параводород
o-Н2 + Н → n*H2 + H








